题目内容
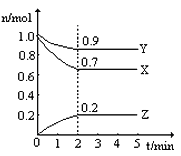
【题目】(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示。由图中数据分析,该反应的化学方程式为:______________。
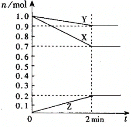
(2)反应开始至2 min,Z的平均反应速率为__________。
(3)达到平衡时X的转化率为__________。
(4)不同时间测得以下反应速率:
①v(X)=0.075 mol· L-1·min-1 ②v(Y)=0.001 mol· L-1·s-1 ③v(Z)=0.06 mol·L-1·min-1
速率由大到小关系正确为______。
A.①>③>② B.③>①>② C.②>③>①
【答案】Y+3X![]() 2Z 0.05mol· L-1·min-1 30% C
2Z 0.05mol· L-1·min-1 30% C
【解析】
(1)根据图像可知:随着反应的进行,X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物而Z为生成物,2min时,△n(X)=1.0mol-0.7mol=0.3mol,△n(Y)=1.0mol-0.9mol=0.1mol,△n(Z)=0.2mol-0=0.2mol,同一可逆反应同一时间段内各物质物质的量变化量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,据此其化学方程式为:Y+3X![]() 2Z,故答案为:Y+3X
2Z,故答案为:Y+3X![]() 2Z。
2Z。
(2)反应开始至2min,Z的平均反应速率为v(Z)=![]() =
= =0.05mol·L-1·min-1,故答案为:0.05mol·L-1·min-1。
=0.05mol·L-1·min-1,故答案为:0.05mol·L-1·min-1。
(3)达到平衡时X的转化率为![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。
(4)根据速率之比等于反应计量数之比可知:
①v(X)=0.075mol·L-1·min-1,则v(Z)=![]() ×0.075mol·L-1·min-1=0.05mol·L-1·min-1;
×0.075mol·L-1·min-1=0.05mol·L-1·min-1;
②v(Y)=0.001mol·L-1·s-1,则v(Z)=2×0.001mol·L-1·s-1=0.002mol·L-1·s-1=0.12mol·L-1·min-1;
③v(Z)=0.06 mol·L-1·min-1
所以反应速率②>③>①,故答案为:C。