题目内容
在通常条件下,下列各组物质的性质排列正确的是( )
| A、水溶性:NH3>H2S>I2 |
| B、沸点:HF>HCl>HBr |
| C、硬度:金刚石>晶体硅>碳化硅 |
| D、熔点:LiF>KF>NaF |
考点:晶体的类型与物质熔点、硬度、导电性等的关系
专题:化学键与晶体结构
分析:A.氨气与水能形成氢键易溶于水,碘单质为非极性分子在水中的溶解度较小;
B.相对分子质量越大,沸点越高,含有氢键的沸点较高;
C.原子晶体中原子半径越小,共价键越强,硬度越大;
D.离子晶体中离子半径越小,离子键越强,熔点越高.
B.相对分子质量越大,沸点越高,含有氢键的沸点较高;
C.原子晶体中原子半径越小,共价键越强,硬度越大;
D.离子晶体中离子半径越小,离子键越强,熔点越高.
解答:
解:A.氨气与水能形成氢键易溶于水,碘单质为非极性分子在水中的溶解度较小,所以水溶性:NH3>H2S>I2,故A正确;
B.相对分子质量越大,沸点越高,含有氢键的沸点较高,HF分子间含有氢键所以沸点最高,沸点:HF>HBr>HCl,故B错误;
C.原子晶体中原子半径越小,共价键越强,硬度越大,原子半径:C>Si,则硬度:金刚石>碳化硅>晶体硅,故C错误;
D.离子晶体中离子半径越小,离子键越强,熔点越高,离子半径:Li+<Na+<K+,则熔点:LiF>NaF>KF,故D错误;
故选A.
B.相对分子质量越大,沸点越高,含有氢键的沸点较高,HF分子间含有氢键所以沸点最高,沸点:HF>HBr>HCl,故B错误;
C.原子晶体中原子半径越小,共价键越强,硬度越大,原子半径:C>Si,则硬度:金刚石>碳化硅>晶体硅,故C错误;
D.离子晶体中离子半径越小,离子键越强,熔点越高,离子半径:Li+<Na+<K+,则熔点:LiF>NaF>KF,故D错误;
故选A.
点评:本题考查了氢键、晶体熔沸点比较等知识,题目难度不大,明确晶体类型与熔沸点大小关系,注意氢键对物质物理性质的影响.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
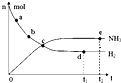 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到化学平衡状态 |
| C、点d和点e处的n(N2)不相同 |
| D、点e反应达到化学平衡状态,反应停止 |
下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液发生反应,也不能使酸性KMnO4溶液褪色的是( )
| A、丙烷 | B、乙醇 | C、乙酸 | D、丙烯 |
氢燃料电池公交汽车已经驶上了一些城市的街头.下列说法正确的是( )
| A、电解水制取氢气是理想且经济的制氢方法 |
| B、利用化石燃料燃烧放热使水分解是理想的制氢方法 |
| C、氢燃料电池汽车的使用可以有效减少城市空气污染 |
| D、发展氢燃料电池汽车不需要安全、高效的储氢技术 |
下列各组物质互为同系物的是( )
| A、金刚石和石墨 |
| B、正丁烷和异丁烷 |
| C、甲烷和乙烷 |
| D、白磷和红磷 |
下列说法正确的是( )
| A、水的离子积就是水的电离平衡常数 |
| B、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
| C、Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中溶解度大小 |
| D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 |
下列描述不符合生产、生活实际的是( )
| A、家用铁锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解水制氢气时,用铜作阳极 |
| C、电解法精炼粗铜,用纯铜作阴极 |
| D、在镀件上电镀锌,用锌作阳极 |
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )
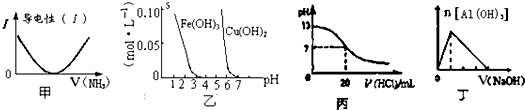

| A、图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| B、由图乙可知若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C、图丙表示25°C时,用0.1mol/L盐酸滴定20mL 0.1mol.L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D、图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
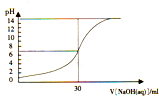 常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )
常温下,15ml某待测物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的滴定曲线如图所示,则两种溶液的物质量的浓度分别是( )