题目内容
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
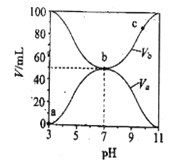
A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
【答案】C
【解析】根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;A.Ka(HA)= c(H+)c(A-)/ c(HA)=10-3×10-3/0.1=1×10-5mol/L,A错误;B.b点二者恰好反应,溶液显中性,则c (B+)=c(A-)>c(OH-)=c(H+),B错误;C.c(A)/c(OH)c(HA)=1/Kh,水解平衡常数只与温度有关,升高温度促进水解,水解平衡常数增大,因此该比值随温度升高而减小, C正确;D.酸或碱抑制水的电离,盐类水解促进水的电离,所以b点水电离出的c(H+)>10-7mol/L,而a、c两点水电离出的c(H+)<10-7mol/L,D错误;答案选C。

【题目】实验室欲配制1mol/L NaOH溶液240ml,请回答:
(1)需称取NaOH固体____________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项____________(填字母)。
附表砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________
【题目】下列实验操作不正确的是
实验目的 | 实验操作 | |
A | 验证化学反应中的能量变化 | 将NO2球浸泡在冰水,热水中观察颜色变化 |
B | 证明非金属性:Cl>C>Si | 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中 |
C | 探究相同条件下,溶液浓度对反应速率的影响 | 在两支试管中各加入4 ml 0.01 mol/L的KMnO4 酸性溶液,再分别加入0.1 mol/L H2C2O4 溶液2 ml、0.2 mol/L H2C2O4 溶液2 mL, 分别记录溶液褪色所需时间 |
D | 除去氢氧化铁中少量的氢氧化铜 | 将过量氨水加入混合物中并充分搅拌,然后过滤、洗涤、干燥 |
A. A B. B C. C D. D
【题目】用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的的是

实验目的 | ②中的试剂 | |
A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
A. A B. B C. C D. D