题目内容
【题目】向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+)
B.x=20时,溶液中所发生反应的离子方程式为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.滴加过程中,生成沉淀的最大物质的量为0.003 mol
【答案】D
【解析】
滴入Ba(OH)2溶液,Ba2+与SO42-反应生成BaSO4沉淀,然后反应的先后顺序是Al3+、NH4+、Al(OH)3,据此分析;
A、当加入10mLBa(OH)2溶液,有1×10-3molBa2+与1×10-3molSO42-反应,SO42-有剩余,OH-先与Al3+反应:Al3++3OH-=Al(OH)3↓,OH-的量不足,2×10-3molOH-消耗![]() mol的Al3+,Al3+有剩余,NH4+不参与反应,因此溶液中含有的离子是NH4+、Al3+、SO42-,溶液中c(NH4+)>c(Al3+),故A错误;
mol的Al3+,Al3+有剩余,NH4+不参与反应,因此溶液中含有的离子是NH4+、Al3+、SO42-,溶液中c(NH4+)>c(Al3+),故A错误;
B、x=20mL时,Ba2+与SO42-恰好完全反应,Al3+与OH-反应生成OH-,多余的OH-全部与NH4+反应生成NH3·H2O,离子反应方程式为NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O,故B错误;
C、当x=30mL时,10mL0.1mol·L-1NH4Al(SO4)2溶液中含有0.001molNH4+、0.001molAl3+、0.002molSO42-,30mL等浓度的Ba(OH)2溶液0.003molBa2+、0.006molOH-,混合后生成BaSO4沉淀,剩余0.001molBa2+,OH-过量溶液中存在0.001molAlO2-,OH-剩余0.001mol,因此溶液有Ba2+、AlO2-、OH-,且c(OH-)>c(AlO2-),故C错误;
D、滴加过程中,生成沉淀的最大物质的量为Al(OH)3、BaSO4,当NH4Al(SO4)2溶液和Ba(OH)2溶液按照物质的量之比为1:2混合,沉淀的量最大为0.002molBaSO4和0.001mol的Al(OH)3,即沉淀的最大量为0.003mol,故D正确;
答案为D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)800℃时,某密闭容器中存在如下反应:2NO2(g) ![]() 2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
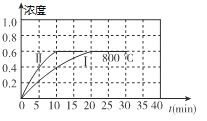
①反应Ⅱ相对于反应I而言,改变的条件可能是_______________.
②800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.5mol/L NO2,则v正____________v逆(填“<”、“>”或“=”)
(2)己知N2O4(g) ![]() 2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表__________(填化学式)的浓度,该反应的平衡常数K=_____________。
②前10min内用NO2浓度变化表示的反应速率为___________,20min时改变的条件是_____________;重新达到平衡时,NO2的质量分数___________________。
a.增大 b.减小
c.不变 d.无法判断
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
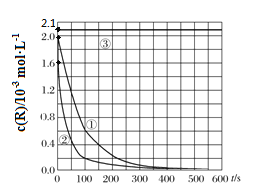
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液