题目内容
重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD="—lg" c(D+),以下关于pD的叙述正确的是
- A.中性溶液中pD=7
- B.在1L D2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12
- C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中pD=2
- D.在100mL 0.25mol·L-1的NaOD重水溶液中加入50mL 0.2mol·L-1DCl的重水溶液,其pD=1
C


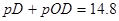
所以,当溶液呈中性时pD=7.2,A错;1L D2O的溶液中溶解0.01mol NaOD,可知NaOD的物质的量浓度为0.01mol/L,该溶液的 ,即
,即 ,B错;1L D2O中溶解 0.01mol DCl,可知DCL的物质的量浓度为0.01mol/L,
,B错;1L D2O中溶解 0.01mol DCl,可知DCL的物质的量浓度为0.01mol/L, ,C正确;NaOD与DCl反应的方程式为:NaOD+DCL=NaCL+D2O,100mL 0.25mol·L-1的NaOD物质的量为0.025mol,50mL 0.2mol·L-1DCl的物质的量为0.01mol,反应后,溶液中剩余的NaOD的物质的量为0.015mol,反应后
,C正确;NaOD与DCl反应的方程式为:NaOD+DCL=NaCL+D2O,100mL 0.25mol·L-1的NaOD物质的量为0.025mol,50mL 0.2mol·L-1DCl的物质的量为0.01mol,反应后,溶液中剩余的NaOD的物质的量为0.015mol,反应后 ,
, ,
, ,D错。
,D错。


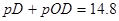
所以,当溶液呈中性时pD=7.2,A错;1L D2O的溶液中溶解0.01mol NaOD,可知NaOD的物质的量浓度为0.01mol/L,该溶液的
 ,即
,即 ,B错;1L D2O中溶解 0.01mol DCl,可知DCL的物质的量浓度为0.01mol/L,
,B错;1L D2O中溶解 0.01mol DCl,可知DCL的物质的量浓度为0.01mol/L, ,C正确;NaOD与DCl反应的方程式为:NaOD+DCL=NaCL+D2O,100mL 0.25mol·L-1的NaOD物质的量为0.025mol,50mL 0.2mol·L-1DCl的物质的量为0.01mol,反应后,溶液中剩余的NaOD的物质的量为0.015mol,反应后
,C正确;NaOD与DCl反应的方程式为:NaOD+DCL=NaCL+D2O,100mL 0.25mol·L-1的NaOD物质的量为0.025mol,50mL 0.2mol·L-1DCl的物质的量为0.01mol,反应后,溶液中剩余的NaOD的物质的量为0.015mol,反应后 ,
, ,
, ,D错。
,D错。 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目