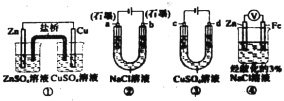
题目内容
【题目】W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为( ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
化学键 | X-O | O=O | X-X |
键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
【答案】 ![]() Si(s)+O2(g)=SiO2(s)△H=-989.2kJ/mol 3Fe+4H2O(g)
Si(s)+O2(g)=SiO2(s)△H=-989.2kJ/mol 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe3++3H2O
Fe3O4+4H2 Fe3++3H2O![]() Fe(OH)3+3H+(不写可逆符号不给分)
Fe(OH)3+3H+(不写可逆符号不给分)
【解析】W、M、X、Y、Z为原子序数依次增大的前四周期元素,Y是第三周期原子半径最小的元素,Y为Cl元素;Z是生活中常见金属,既不属于主族,也不属于副族,Z属于第Ⅷ族,Z为Fe元素;非金属元素W所在周期数等于族序数,则W为H元素;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;则M为第2周期元素,为C,X为Si元素。
(1)H与C可以形成多种化合物,其中最简单化合物为甲烷,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据题意,硅在氧气中燃烧生成二氧化硅,其中硅和二氧化硅均为原子晶体,其中1 mol Si中含有2 mol Si—Si 键;1 mol SiO2中含有4 mol Si—O键;则硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=反应物总键能-生成物总键能=176×2+498.8-460×4=-989.2kJ/mol,故答案为:Si(s)+O2(g)=SiO2(s)△H=-989.2kJ/mol;
(3)铁与H2O蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(4)氯化铁属于强酸弱碱盐,水解显酸性,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+,故答案为: Fe3++3H2O
Fe(OH)3+3H+,故答案为: Fe3++3H2O![]() Fe(OH)3+3H+。
Fe(OH)3+3H+。

【题目】红矾钠(Na2Cr2O7·2H2O)广泛用作强氧化剂、鞣革剂。以铬矿石(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取红矾钠的流程如下:

已知:①CrO42-与Cr2O72-存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
Cr2O72-+H2O,当pH<3时,以Cr2O72-为主,当pH>9时,以CrO42-为主。
②钠盐在不同温度下的溶解度(g):
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Na2SO4 | 9.0 | 19.4 | 40.8 | 48.8 | 46.7 | 45.3 | 44.1 | 43.7 |
Na2Cr2O7 | 170.2 | 180.1 | 196.7 | 220.5 | 248.4 | 283.1 | 323.8 | 385.4 |
注32.38℃以上,与饱和溶液平衡的固相为无水Na2SO4,以下则为Na2SO4·10H2O。
③Cr3+完全沉淀时pH为6.8,Cr(OH)3开始溶解时pH为12。
请回答下列问题:
(1)煅烧铬矿石时,生成Na2CrO4的化学反应方程式为_________
(2)滤渣Ⅱ的成分是__________(填化学式)。
(3)有人认为工艺流程中“用稀硫酸调pH”改为“通入过量CO2”,不需调节pH同样可以达到实验效果,理由是___________。
(4)向红矾钠溶液中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________
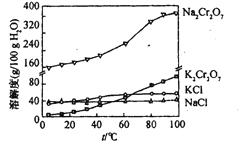
A.80 B.60 C.40 D.10
(5)该工艺所得副产品主要为无水硫酸钠并混有少量重铬酸钠,请设计从副产品获得芒硝(Na2SO4·10H2O)的实验方案:将该副产品按固液质量比100:230溶于热水,加入稍过量的Na2SO3溶液,搅拌,____,过滤,洗涤,低温干燥。(实验中须使用的试剂:稀H2SO4、NaOH溶液)。
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。