题目内容
(2010?金华模拟)下列说法中正确的是( )
分析:A、生铁炼成钢的过程和目的分析判断;
B、从金属的结构特征,只能失去单质表现为还原性分析;
C、盐和碱反应可以生成盐和水,从酸式盐的反应分析,氧化性酸雨还原性碱的反应分析;
D、从水解和电离的程度大小分析判断;
B、从金属的结构特征,只能失去单质表现为还原性分析;
C、盐和碱反应可以生成盐和水,从酸式盐的反应分析,氧化性酸雨还原性碱的反应分析;
D、从水解和电离的程度大小分析判断;
解答:解:A、生铁炼钢的过程是降碳量、除硫磷、调硅锰,不可能除去所有元素,故A错误;
B、金属只有还原性,故B错误;
C、酸式盐和对应碱反应生成盐和水,如碳酸氢钠与氢氧化钠反应,氧化性的酸与还原性的碱反应产物不是盐和水,如氢氧化铁和硝酸反应,故C错误;
D、同体积同物质的量浓度的Na2SO3、Na2S、NaHSO3、H2SO3溶液中溶质物质的量相同,根据组成可知Na2SO3、Na2S溶液中的溶质离子数大于NaHSO3、H2SO3溶液中溶质的离子数,Na2SO3、Na2S溶液中由于硫离子水解必亚硫酸根的水解程度大,故溶液中溶质离子数Na2SO3>Na2S;NaHSO3是强电解质、H2SO3是弱电解质,溶液中溶质离子数NaHSO3>H2SO3;
故选D.
B、金属只有还原性,故B错误;
C、酸式盐和对应碱反应生成盐和水,如碳酸氢钠与氢氧化钠反应,氧化性的酸与还原性的碱反应产物不是盐和水,如氢氧化铁和硝酸反应,故C错误;
D、同体积同物质的量浓度的Na2SO3、Na2S、NaHSO3、H2SO3溶液中溶质物质的量相同,根据组成可知Na2SO3、Na2S溶液中的溶质离子数大于NaHSO3、H2SO3溶液中溶质的离子数,Na2SO3、Na2S溶液中由于硫离子水解必亚硫酸根的水解程度大,故溶液中溶质离子数Na2SO3>Na2S;NaHSO3是强电解质、H2SO3是弱电解质,溶液中溶质离子数NaHSO3>H2SO3;
故选D.
点评:本题考查了炼钢原理、金属的结构特征、酸式盐与碱反应和酸碱反应的产物判断,盐类水解程度大小及离子数的比较.

练习册系列答案
相关题目
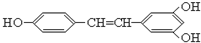 (2010?金华模拟)白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )
(2010?金华模拟)白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )