题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B. 33.6LNO2溶解于足量的水中得到硝酸溶液,溶液中NO3-的数目为NA
C. 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数为2NA
D. 高温下,0.3molFe与足量水蒸气反应,生成的H2分子的数目为0.4NA
【答案】D
【解析】A. 室温下,1LpH=13的NaOH溶液中,c(OH-)=0.1mol/L,c(H+)==10-13mol/L,则由水电离出来的c水(OH-)=c(H+)=10-13mol/L,物质的量为:1L×10-13mol/L =10-13mol,数目10-13 NA,故A错误;B. 因未指明NO2气体所处的状态是否为标准状况,则无法计算NO2的物质的量,NO2溶于水后溶液中的NO3-的数目也无法计算,故B错误;C. 氢氧燃料电池正极的电极反应式为:O2+4H++4e-=2H2O,则消耗标准状况下22.4L即1mol O2时,电路中有4NA个电子通过,故C错误;D. 根据方程式3Fe+4H2O(g) ![]() Fe3O4+4H2可知,0.3molFe与足量水蒸气反应,生成H2的物质的量为0.4mol,H2分子的数目为0.4NA,故D正确;答案选D。
Fe3O4+4H2可知,0.3molFe与足量水蒸气反应,生成H2的物质的量为0.4mol,H2分子的数目为0.4NA,故D正确;答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | ||
A | 25 | 5 | 0.1 | 20 | 0.1 |
B | 25 | 5 | 0.2 | 10 | 0.2 |
C | 35 | 5 | 0.1 | 20 | 0.1 |
D | 35 | 5 | 0.2 | 10 | 0.2 |
A.A
B.B
C.C
D.D
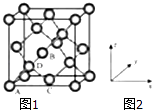
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 .
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为gcm﹣3(列出计算式即可).