题目内容
【题目】将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
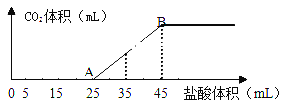
(1)写出OA段所发生反应的离子方程式_____________、___________。
(2)当加入45mL盐酸时,产生CO2的体积为______________mL(标准状况)。
(3)写出碳酸钠溶液呈碱性的原因(用离子方程式表示)_____________。
【答案】H++OH-=H2O CO32-+H+=HCO3- 448 CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
【解析】
碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水后,碳酸氢钠与氢氧化钠可以反应生成碳酸钠。由图像可知,当向此溶液中加入25mL盐酸之后才开始生成二氧化碳,再加20mL盐酸后,气体体积达到最大值,由碳酸钠和盐酸反应的离子方程式CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2![]() 可知,与前25mL盐酸反应的物质中除碳酸钠外一定还有氢氧化钠。
可知,与前25mL盐酸反应的物质中除碳酸钠外一定还有氢氧化钠。
(1)OA段所发生反应的离子方程式H++OH-=H2O、CO32-+H+=HCO3-。
(2)当加入45mL盐酸时,由AB段发生的离子反应HCO3-+H+=H2O+CO2![]() ,可以计算出产生CO2的物质的量为n(CO2)=0.02L
,可以计算出产生CO2的物质的量为n(CO2)=0.02L![]() 1mol/L=0.02mol,所以在标准状况下的体积为448mL。
1mol/L=0.02mol,所以在标准状况下的体积为448mL。
(3)碳酸钠溶液呈碱性的原因为碳酸根水解使溶液呈碱性。碳酸根水解分两步进行,但是以第一步为主,溶液的碱性也由第一步决定,用离子方程式可表示为CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。

练习册系列答案
相关题目