题目内容
7.相同质量的钠、镁、铝分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比为36:69:92;这三种金属各取等物质的量,也分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比1:2:3.分析 设钠、镁、铝的质量为1g,带入n=$\frac{m}{M}$计算物质的量,根据2Na~H2↑、Mg~H2↑、2Al~3H2↑计算生成氢气的物质的量,同温同压下产生的气体的体积比等于物质的量之比;设钠、镁、铝的物质的量均为1mol,根据化学方程式中的计量关系来求算.
解答 解:设钠、镁、铝的质量为1g,
n(Na)=$\frac{1g}{23g/mol}$=$\frac{1}{23}$mol,由2Na~H2↑可知,生成n(H2)=$\frac{1}{2}×\frac{1}{23}$mol=$\frac{1}{46}$mol,
n(Mg)=$\frac{1g}{24g/mol}$=$\frac{1}{24}$mol,由Mg~H2↑可知,生成n(H2)=$\frac{1}{24}$mol,
n(Al)=$\frac{1g}{27g/mol}$=$\frac{1}{27}$mol,由2Al~3H2↑可知,生成n(H2)=$\frac{1}{27}$mol×$\frac{3}{2}$=$\frac{1}{18}$mol,
同温同压下产生的气体的体积比等于物质的量之比=$\frac{1}{46}$mol:$\frac{1}{24}$mol:$\frac{1}{18}$mol=36:69:92;
设钠、镁、铝的物质的量均为1mol,根据化学方程式中的计量关系可知:
1mol钠,由2Na~H2↑可知,生成n(H2)=0.5mol,
1mol镁,由Mg~H2↑可知,生成n(H2)=1mol,
1mol铝,由2Al~3H2↑可知,生成n(H2)=$\frac{3}{2}$mol.
而相同状态下,气体的体积之比等于物质的量之比,故生成的氢气在同温、同压下产生气体的体积比为:0.5:1:$\frac{3}{2}$=1:2:3.
故答案为:36:69:92;1:2:3.
点评 本题考查物质的量的有关计算,难度不大,明确2Na~H2↑、Mg~H2↑、2Al~3H2↑的物质的量关系是解题的关键,注意同温同压下产生的气体的体积比等于物质的量之比.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | Z+1 | B. | Z+11 | C. | Z+25 | D. | Z+32 |
| A. | 11.5g/mol | B. | 24.3g/mol | C. | 48.4g/mol | D. | 16.2g/mol |
| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
| SO2 | 2mol | |||
| SO42- | 6.02×1022 | |||
| NH4+ | 18g | . |
| 选项 | ① | ② | ③ | 实验结论 | 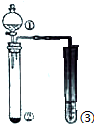 |
| A | 稀硫酸 | KI | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(AgI) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、强氧化性 | |
| C | 稀盐酸 | Na2SO3 | KMnO4溶液 | SO2有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 未加醋酸时:c(OH-)=c(Na+) | |
| B. | 加入10mL醋酸时:c(OH-)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | 加入醋酸至溶液pH=7时:c(CH3COO-)=c(Na+) | |
| D. | 加入20mL醋酸时:2c(OH-)=c(CH3COO-)+2c(H+) |
 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是: