题目内容
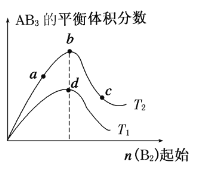
【题目】已知:2X+Y![]() 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
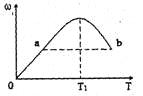
A. T1时,v正>v逆
B. 正反应的△H<0
C. a、b两点的反应速率va=vb
D. T<T1时,ω增大的原因是平衡向正方向移动
【答案】B
【解析】试题分析:当可逆反应达到化学平衡状态时,产物Z的生成率最大,物质的量分数最大,所以T1时刻,化学反应达到了平衡状态。A、T1时,化学反应达到了平衡状态,v正=v逆,A错误;B、当温度高于T1时,Z的物质的量分数逐渐减小,所以化学平衡逆向移动,即逆反应方向是吸热的,所以正反应是一个放热反应,即△H<0,B正确;C、温度越高,化学反应速率越大,b点温度高于a点,所以b的速率高于a点的速率,即va<vb,C错误;D、0-T1阶段是化学平衡的建立过程,反应开始向右不断进行,生成的Z的量越来越大,所以ω增大,D错误,答案选B。

练习册系列答案
相关题目