题目内容
【题目】镍具有铁磁性和延展性,能导电和导热。镍单质及其化合物的化学性质与铁相似。
(1)镍易溶于稀的无机酸中,并放出氢气,写出镍与盐酸反应的化学方程式:_____________。
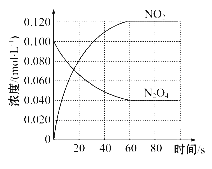
(2)在隔绝空气的条件下,加热NiC2O4使其分解,就能得到暗绿色的氧化亚镍,写出该反应的化学方程式: _____________。
(3)Ni2O3不溶于水,可溶于盐酸并放出氯气,写出该反应的离子方程式: _____________。
(4)氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:H2+2NiO(OH) ![]() 2Ni(OH)2。写出放电时的正极反应式: _____________。
2Ni(OH)2。写出放电时的正极反应式: _____________。
(5)纳米材料镍粉(Ni)是一种高性能电极材料,其制备过程如下:
步骤I:取0.2mol/L的硝酸亚镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol/L的NaHCO3溶液使Ni2+完全沉淀,生成:xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12LN2和CO2的混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式_______________。
【答案】 Ni+2HCl=NiCl2+H2↑ NiC2O4![]() NiO+CO↑+CO2↑ Ni2O3+6H++2Cl-=2Ni2++Cl2↑+3H2O 2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-或NiO(OH)+e-+H2O=Ni(OH)2+OH- NiCO3·2Ni(OH)2·4H2O
NiO+CO↑+CO2↑ Ni2O3+6H++2Cl-=2Ni2++Cl2↑+3H2O 2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-或NiO(OH)+e-+H2O=Ni(OH)2+OH- NiCO3·2Ni(OH)2·4H2O
【解析】(1)镍单质及其化合物的化学性质与铁相似,镍与盐酸反应生成NiCl2和氢气,反应的化学方程式为:Ni+2HCl=NiCl2+H2↑;(2)在隔绝空气的条件下,加热NiC2O4使其分解,就能得到暗绿色的氧化亚镍,NiC2O4中Ni的化合价为+2价,碳的化合价为+3,生成NiO中Ni的化合价为+2价不变,根据氧化还原反应原理,则若产生气体为CO2同时应该还产生CO,反应的化学方程式为:NiC2O4![]() NiO+CO↑+CO2↑;(3)Ni2O3不溶于水,可溶于盐酸并放出氯气,反应的离子方程式为:Ni2O3+6H++2Cl-=2Ni2++Cl2↑+3H2O;(4)氢镍电池的总反应式是:H2+2NiO(OH)
NiO+CO↑+CO2↑;(3)Ni2O3不溶于水,可溶于盐酸并放出氯气,反应的离子方程式为:Ni2O3+6H++2Cl-=2Ni2++Cl2↑+3H2O;(4)氢镍电池的总反应式是:H2+2NiO(OH) ![]() 2Ni(OH)2。放电时为原电池,正极上NiO(OH)得电子被还原生成2Ni(OH)2,电极反应式为:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-或NiO(OH)+e-+H2O=Ni(OH)2+OH-;(5)n(CO2)+n(N2)=
2Ni(OH)2。放电时为原电池,正极上NiO(OH)得电子被还原生成2Ni(OH)2,电极反应式为:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-或NiO(OH)+e-+H2O=Ni(OH)2+OH-;(5)n(CO2)+n(N2)= ![]() =0.05mol,1molxNiCO3·yNi(OH)2·zH2O生成二氧化碳xmol,生成氮气的物质的量由Ni被还原进行求算,为
=0.05mol,1molxNiCO3·yNi(OH)2·zH2O生成二氧化碳xmol,生成氮气的物质的量由Ni被还原进行求算,为![]() mol,n(NiO)=
mol,n(NiO)= ![]() =0.06mol,设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:a +
=0.06mol,设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:a + ![]() =0.05mol,x+y=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)=
=0.05mol,x+y=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)= ![]() =0.08 mol,x:y:z=n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O。
=0.08 mol,x:y:z=n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大