题目内容
【题目】下列离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.少量的二氧化碳气体通入足量烧碱溶液中反应CO2+OH-=HCO3-
C.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向碳酸钙中滴加醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑
【答案】C
【解析】
A.硫酸与氢氧化钡溶液混合反应生成硫酸钡和水,离子反应为![]() ,故A错误;
,故A错误;
B.少量的二氧化碳气体通入足量烧碱溶液中反应生成碳酸钠和水,其离子反应方程式为:![]() ,故B错误;
,故B错误;
C.向FeBr2溶液中通入过量Cl2生成FeCl3、Br2,离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C正确;
D.醋酸为弱电解质,碳酸钙为固体,二者反应的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故答案为:C。

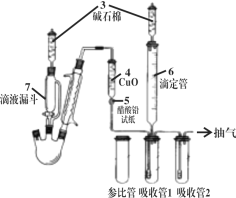
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
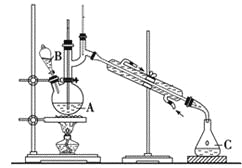
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。