题目内容
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸.
已知:①550℃时,2S02(g)+02(g)
2S03(g)△H=一196.6kJ?mol-1.
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积比为4:1):
3FeS2+802=Fe304+6S02,4FeS2+1102=2Fe203+8S02.
(1)550℃时,6.4g S02(g)与足量O2(g)充分反应生成S03(g),放出热量 9.83kJ(填“大于”、“等于”或“小于”)0、
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 .(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入02
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe203,生产时要使用过量的空气,则当空气过量50%时,所得炉气中S02的体积分数是多少?
(4)720g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6:a,此时消耗空气为bmol.
①试写出b与a的关系式: .
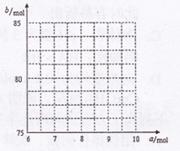
②请在如图中画出b与a的关系曲线.
已知:①550℃时,2S02(g)+02(g)
| 催化剂△ |
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积比为4:1):
3FeS2+802=Fe304+6S02,4FeS2+1102=2Fe203+8S02.
(1)550℃时,6.4g S02(g)与足量O2(g)充分反应生成S03(g),放出热量
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是
a.向平衡混合物中充入Ar b.向平衡混合物中充入02
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe203,生产时要使用过量的空气,则当空气过量50%时,所得炉气中S02的体积分数是多少?
(4)720g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6:a,此时消耗空气为bmol.
①试写出b与a的关系式:
②请在如图中画出b与a的关系曲线.

分析:(1)S02与02反应为可逆反应,根据可逆反应的特点可知,反应物不能完全转化为反应物;
(2)使反应①的平衡向正反应方向移动,根据影响平衡的因素分析;
(3)根据反应方程式,由氧气的量求出二氧化硫的量,再求其体积分数;
(4)①根据反应前后氧原子守恒计算;
②采用极限法,若固体中只有Fe304,根据n(Fe):n(O)=6:a,则a=8,b=80;若固体中只有Fe203,则a=9,b=82.5,依此作图.
(2)使反应①的平衡向正反应方向移动,根据影响平衡的因素分析;
(3)根据反应方程式,由氧气的量求出二氧化硫的量,再求其体积分数;
(4)①根据反应前后氧原子守恒计算;
②采用极限法,若固体中只有Fe304,根据n(Fe):n(O)=6:a,则a=8,b=80;若固体中只有Fe203,则a=9,b=82.5,依此作图.
解答:解:(1)6.4g S02的物质的量为:
=0.1mol,已知S02与02反应为可逆反应,根据可逆反应的特点可知,反应物不能完全转化为反应物,所以放出的热量小于
×196.6kJ=9.83kJ,故答案为:小于;
(2)使反应①2S02(g)+02(g)
2S03(g)△H=一196.6kJ?mol-1的平衡向正反应方向移动,
a.向平衡混合物中充入Ar,容器体积不变,反应物质的浓度不变,平衡不移动,故a错误;
b.向平衡混合物中充入02,反应物氧气的浓度增大,平衡正向移动,故b正确;
c.改变反应的催化剂,平衡不移动,故c错误;
d.降低反应的温度,平衡向正方向移动,故d在;
故答案为:bd;
(3)根据反应方程式4FeS2+1102=2Fe203+8S02,
设FeS2为1 mol,完全煅烧需要的n(O2)=
=2.75 mol,生成n(SO2)=2 mol;
空气过量50%,所需空气为:
×1.5=20.625 mol;
则SO2体积分数为:
×100%=10.0%,
答:所得炉气中S02的体积分数10.0%;
(4)①720g纯净的FeS2的物质的量为
=6mol,则n(Fe)=6mol,n(S)=12mol;反应后生成n(S02)=24mol,消耗空气为bmol,则空气中n(02)=
mol;
根据反应前后氧原子守恒:
×2=a+24,则b=2.5a+60;故答案为:b=2.5a+60;
②采用极限法分析,若固体中只有Fe304,根据n(Fe):n(O)=6:a,则a=8,b=80;若固体中只有Fe203,则a=9,b=82,所以端点为(8,80)、(9,82.5)之间的一条线段,则图为: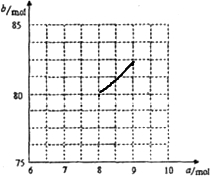 ;
;
故答案为: .
.
| 6.4g |
| 64g/mol |
| 0.1 |
| 2 |
(2)使反应①2S02(g)+02(g)
| 催化剂△ |
a.向平衡混合物中充入Ar,容器体积不变,反应物质的浓度不变,平衡不移动,故a错误;
b.向平衡混合物中充入02,反应物氧气的浓度增大,平衡正向移动,故b正确;
c.改变反应的催化剂,平衡不移动,故c错误;
d.降低反应的温度,平衡向正方向移动,故d在;
故答案为:bd;
(3)根据反应方程式4FeS2+1102=2Fe203+8S02,
设FeS2为1 mol,完全煅烧需要的n(O2)=
| 11 |
| 4 |
空气过量50%,所需空气为:
| 2.75 |
| 0.2 |
则SO2体积分数为:
| 2 |
| 20.625+2-2.75 |
答:所得炉气中S02的体积分数10.0%;
(4)①720g纯净的FeS2的物质的量为
| 720g |
| 120g/mol |
| b |
| 5 |
根据反应前后氧原子守恒:
| b |
| 5 |
②采用极限法分析,若固体中只有Fe304,根据n(Fe):n(O)=6:a,则a=8,b=80;若固体中只有Fe203,则a=9,b=82,所以端点为(8,80)、(9,82.5)之间的一条线段,则图为:
 ;
;故答案为:
 .
.点评:本题考查了反应热的计算,化学平衡移动,根据方程式的计算,题目计算量较大,过程比较复杂,综合考查学生分析解决问题的能力,注意守恒思想的运用,难度中等.

练习册系列答案
相关题目
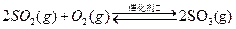
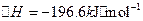
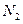 与
与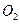 的体积
的体积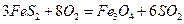 ,
,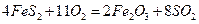
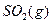 与足量
与足量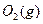 充分反应生成
充分反应生成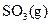 ,放出热量
,放出热量 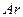 b.向平衡混合物中充入
b.向平衡混合物中充入 完全生成
完全生成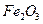 ,生产时要使用过量的
,生产时要使用过量的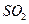 的
的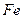 和
和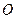 的物质的量之比n(
的物质的量之比n( ,
,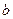 mol。
mol。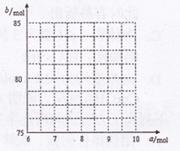
 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中