��Ŀ����
(10��)�������������й㷺��Ӧ�ã�ij����������Ϊ��Ҫԭ���������ᡣ
��֪����550��ʱ��![]()
![]()
��һ���¶��£��������ڿ��������տ��ܷ������з�Ӧ(�������![]() ��
��![]() �����
�����
��Ϊ4��1)��![]() ,
,![]()
(1) 550��ʱ��6��4 g ![]() ������
������![]() ��ַ�Ӧ����
��ַ�Ӧ����![]() ���ų�����
���ų�����
9��83 kJ
(����ڡ��������ڡ���С�ڡ�)o
(2)��ʹ��Ӧ�ٵ�ƽ��������Ӧ�����ƶ������д�ʩ���е��� ��(����ĸ)
a����ƽ�������г���![]() b����ƽ�������г���
b����ƽ�������г���![]()
c���ı䷴Ӧ�Ĵ��� d�����ͷ�Ӧ���¶�
(3)Ϊʹ![]() ��ȫ����
��ȫ����![]() ������ʱҪʹ�ù�����
������ʱҪʹ�ù�����
 ��������������50��ʱ������¯����
��������������50��ʱ������¯����![]() ��
��
��������Ƕ���?
(4)720 g������![]() �ڿ�������ȫ���գ����ù���
�ڿ�������ȫ���գ����ù���
��![]() ��
��![]() �����ʵ���֮��n(
�����ʵ���֮��n(![]() )��n(
)��n(![]() )=6:
)=6: ![]() ��
��
��ʱ���Ŀ���Ϊ![]() mol��
mol��
����д������ڵĹ�ϵʽ�� ��
��������ͼ�л���![]() ��
��![]() �Ĺ�ϵ���ߡ�
�Ĺ�ϵ���ߡ�
��10�֡�ÿ������2�֡�
��1���� ��2��bd
��3����FeS2Ϊ1 mol����ȫ������Ҫ��n(O2) = 2.75 mol������n(SO2) = 2 mol��
��������50%�����������2.75 �� 0.2 �� 1.5 = 20.625 mol��
SO2 ���������2 �� ( 20.625 + 2�� 2.75) = 10.0%
��4���� b = 2.5a + 60
�� �˵�Ϊ��8��80������9��82.5��֮���һ���߶�

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�(14��)���Ṥҵ��2SO2(g)��O2(g)������2SO3(g)����H<0(���ȷ�Ӧ)�й�ʵ���������£�
|
SO2�� ת���� �¶� |
1��105 Pa |
5��105 Pa |
10��105 Pa |
50��105 Pa |
100��105 Pa |
|
450 �� |
97.5% |
98.9% |
99.2% |
99.6% |
99.7% |
|
550 �� |
85.6% |
92.9% |
94.9% |
97.7% |
98.3% |
(1)�������г��ù����Ŀ�����Ϊ��________��
(2)���¶Ը÷�Ӧ�к�Ӱ�죿________��ʵ�������в���400��500 ����¶ȳ��˿������������⣬�����ǵ�________��
(3)����ѹǿ��������Ӧ�к�Ӱ�죿____������ҵ���ֳ����ó�ѹ���з�Ӧ����ԭ����______________��
(4)����ŨH2SO4������ˮ����SO3������___ ___��β����SO2������գ���Ҫ��Ϊ��________��

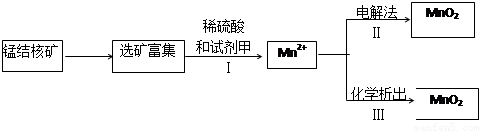
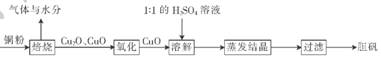
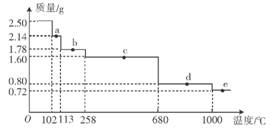
 ѹǿ
ѹǿ