题目内容
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]() △H=-196.6KJ.mol-1
△H=-196.6KJ.mol-1
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g SO2(g)与足量O2(g)充分反应生成SO3(g),放出热量
9.83 kJ (填“大于”、“等于”或“小于”)。
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中SO2的体积分数是多少?
(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
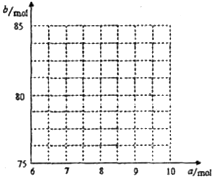
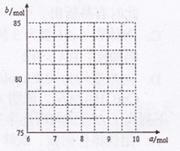
①试写出a与b的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
(1)小于 (2)bd
(3)设FeS2为1 mol,完全煅烧需要的n(O2) = 2.75 mol,生成n(SO2) = 2 mol;
空气过量50%,所需空气为:2.75 ÷ 0.2 × 1.5 = 20.625 mol;
SO2 体积分数为:2 ÷ ( 20.625 + 2- 2.75) = 10.0%
(4)① b = 2.5a + 60
② 端点为(8,80)、(9,82.5)之间的一条线段

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
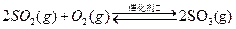
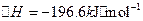
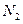 与
与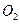 的体积
的体积 ,
,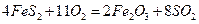
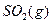 与足量
与足量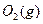 充分反应生成
充分反应生成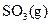 ,放出热量
,放出热量 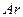 b.向平衡混合物中充入
b.向平衡混合物中充入 完全生成
完全生成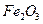 ,生产时要使用过量的
,生产时要使用过量的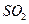 的
的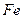 和
和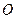 的物质的量之比n(
的物质的量之比n( ,
,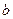 mol。
mol。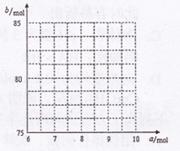 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中 空气,则当空气过量50%时,所得炉气中
空气,则当空气过量50%时,所得炉气中