题目内容
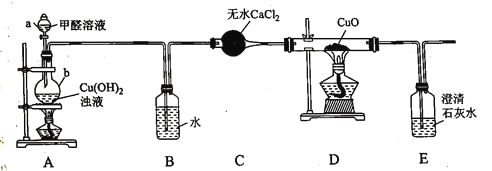
【题目】硫酸亚铁铵![]() 又称摩尔盐,某实验小组利用如图装置制取摩尔盐并测其纯度。
又称摩尔盐,某实验小组利用如图装置制取摩尔盐并测其纯度。

Ⅰ![]() 摩尔盐的制取:
摩尔盐的制取:
(1)仪器a的名称为:_________________
(2)检查装置气密性,加入药品,先关闭![]() ,打开
,打开![]() 、
、![]() 和仪器a活塞,装置B中有气体产生,该气体的作用是______________。反应一段时间后,欲使摩尔盐在装置A中生成的对应操作为___________。
和仪器a活塞,装置B中有气体产生,该气体的作用是______________。反应一段时间后,欲使摩尔盐在装置A中生成的对应操作为___________。
Ⅱ![]() 摩尔盐纯度测定:取
摩尔盐纯度测定:取![]() 硫酸亚铁铵样品配制成
硫酸亚铁铵样品配制成![]() 溶液,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
溶液,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
![]() 甲
甲![]() 方案一:取
方案一:取![]() 硫酸亚铁铵溶液用
硫酸亚铁铵溶液用![]() 的酸性
的酸性![]() 溶液进行三次滴定。
溶液进行三次滴定。
![]() 乙
乙![]() 方案二:
方案二:
![]()

![]() 丙
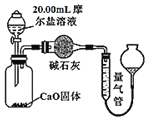
丙![]() 方案三:实验设计图如图所示:
方案三:实验设计图如图所示:
(3)写出方案一发生反应的离子方程式____________,若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因: _________;设计实验验证你的推测:_____________。
(4)方案三测得![]() 的体积为
的体积为![]() 已折算为标准状况下
已折算为标准状况下![]() ,计算摩尔盐的纯度________。
,计算摩尔盐的纯度________。![]() 计算结果保留一位小数
计算结果保留一位小数![]()
【答案】分液漏斗 排除装置A中的氧气,避免氧化![]() 打开
打开![]() ,关闭
,关闭![]() 和
和![]()
![]()
![]()
![]()
![]()
![]()
![]() 摩尔盐中
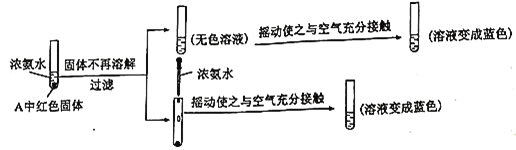
摩尔盐中![]() 被空气部分氧化 取少量硫酸亚铁铵溶液于试管中,加入少量KSCN溶液,若溶液变为血红色,说明
被空气部分氧化 取少量硫酸亚铁铵溶液于试管中,加入少量KSCN溶液,若溶液变为血红色,说明![]() 已被空气部分氧化
已被空气部分氧化 ![]()
【解析】
Ⅰ![]() 摩尔盐的制取
摩尔盐的制取
(1)根据仪器的构造进行判断;
(2)生成的硫酸亚铁易被氧化,注意操作顺序的先后;
Ⅱ![]() 摩尔盐纯度测定
摩尔盐纯度测定
(3)根据氧化还原反应原理分析实验方案。
![]() 方案三测得
方案三测得![]() 的体积为V
的体积为V![]() 已折算为标准状况下
已折算为标准状况下![]() ,根据
,根据![]() 进行计算。
进行计算。
Ⅰ![]() 摩尔盐的制取
摩尔盐的制取
(1)仪器a为分液漏斗;
故答案为:分液漏斗;
(2)生成的硫酸亚铁易被氧化,根据分析,检查装置气密性,加入药品,先关闭![]() ,打开
,打开![]() 、
、![]() 和仪器a活塞,装置B中有氢气产生,可以排除装置A中的氧气,避免氧化
和仪器a活塞,装置B中有氢气产生,可以排除装置A中的氧气,避免氧化![]() ,反应一段时间后,打开
,反应一段时间后,打开![]() ,关闭
,关闭![]() 和
和![]() ,将B中产生的硫酸亚铁压入A装置反应;
,将B中产生的硫酸亚铁压入A装置反应;
故答案为:排除装置A中的氧气,避免氧化![]() ;打开
;打开![]() ,关闭
,关闭![]() 和
和![]() ;
;
Ⅱ![]() 摩尔盐纯度测定
摩尔盐纯度测定
(3)方案一中的反应为:![]() ;方案一通过
;方案一通过![]() 的量计算硫酸亚铁铵,方案二通过
的量计算硫酸亚铁铵,方案二通过![]() 的量计算硫酸亚铁铵,方案一的测定结果总是小于方案二,说明摩尔盐中
的量计算硫酸亚铁铵,方案一的测定结果总是小于方案二,说明摩尔盐中![]() 被空气部分氧化,致
被空气部分氧化,致![]() 偏小;
偏小;![]() 被空气部分氧化会生成
被空气部分氧化会生成![]() ,取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明
,取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明![]() 已被空气部分氧化;
已被空气部分氧化;
故答案为:![]() ;摩尔盐中
;摩尔盐中![]() 被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明
被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明![]() 已被空气部分氧化;
已被空气部分氧化;
![]() 方案三测得
方案三测得![]() 的体积为V
的体积为V![]() 已折算为标准状况下
已折算为标准状况下![]() ,根据
,根据![]() ,则
,则![]() 摩尔盐
摩尔盐![]() ,故摩尔盐的纯度为
,故摩尔盐的纯度为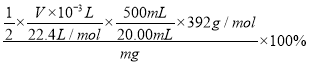 =
=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案