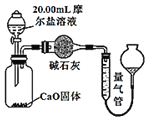
题目内容
【题目】在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________mol
②反应的平衡常数K=_________________;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
【答案】< 4 75 0.06mol﹒L﹒min-1 B
【解析】
(1)根据气体的计算数进行判断;
(2)根据三行式,结合A转化率=![]() ×100%,平衡常数K=
×100%,平衡常数K=![]() ,反应速率=
,反应速率=
![]() 进行计算;
进行计算;
(3) 根据平衡移动原理进行分析。
(1)该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零,故ΔS<0;
(2)①若温度T2时,5min后反应达到平衡,CO的转化率为75%,则反应的CO的物质的量为:2mol×75%=1.5mol,反应的氢气的物质的量为:1.5mol×2=3mol,平衡时CO的物质的量为:2-1.5=0.5mol,氢气的物质的量为5-3=2mol,甲醇的物质的量为1.5mol,故平衡时体系总的物质的量为0.5+2+1.5=4mol;
②平衡时CO的物质的量为0.5mol,氢气的物质的量为2mol,甲醇的物质的量为1.5mol,则平衡常数K=![]() =
=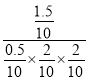 =75L2/mol2;
=75L2/mol2;
③反应的氢气的物质的量为3mol,故v(H2)=![]() =0.06 molL-1min-1;
=0.06 molL-1min-1;
(3) 反应CO(g)+2H2(g)=CH3OH(g) △H<0为气体体积减小的放热反应。
A. 向反应器中再充入CO,反应正向移动,但加入的量比转化的少得多,则CO的转化率反而减小,选项A不符合;
B. 向反应器中再充入H2 ,反应正向移动,CO的转化率增大,选项B符合;
C. 向反应器中再充入CH3OH,反应逆向移动,CO的转化率减小,选项C不符合;
D. 向反应器中再充入He,各反应物的浓度不变,平衡不移动,CO的转化率不变,选项D不符合;
答案选B。

【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)