题目内容
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是
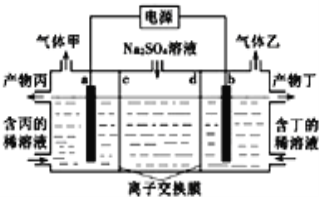
A. 左侧a极与电源的负极相连
B. 电解使右侧溶液的pH减小
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. 当电路中通过1mol电子时,气体甲在标准状况下的体积为11.2L。
【答案】C
【解析】
由装置图分析可以知道是电解装置,电极硫酸钠溶液,实质是电解水,气体甲与气体乙的体积比约为1:2,气体甲为氧气,气体乙为氢气,阳极生成氧气,电极反应4OH--4e-=2H2O+O2↑,阴极生成氢气,2H++2e-=H2↑,气体体积比为1:2,所以判断a电极是阳极,b电极是阴极,在阳极室得到硫酸,在阴极室得到氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜。据此分析。
A、根据以上分析可以知道a电极为阳极,与电源正极相连,故A错误;
B、右侧阴极生成氢气,电极反应2H++2e-=H2↑,消耗H+,pH增大,故B错误;
C、阳极a生成氧气,电极反应4OH--4e-=2H2O+O2↑,阳极室水的电离平衡被破坏生成氢离子,生成产物丙为硫酸,阴极生成氢气,2H++2e-=H2↑,生成产物丁为氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜,故C正确;
D、气体甲为氧气,阳极生成氧气,电极反应4OH--4e-=2H2O+O2↑,由电极反应式可知,当电路中通过1mol电子时,生成0.25mol氧气,在标准状况下的体积为5.6L,所以D选项是错误的。
所以C选项是正确的。

 应用题作业本系列答案
应用题作业本系列答案【题目】(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: __________________。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是________;下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
②25℃时, 等浓度的Na2CO3、CH3COONa 和NaClO三种溶液的pH从小到大依次是____________。
(3) 25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比, ___________ (填化学式)溶液中的c(Mg2+)大。
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中 c(CH3COO-)-c(Na+)=_________mol·L-1(填计算式,不用求具体值)。
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)_____ (填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 | B.v正(NO)="2" v正(O2) |
C.气体平均摩尔质量在此条件下达到最大 | D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。


