题目内容
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是( )
2C(气)+2D(固)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、B、C、D的分子数之比为1:3:2:2
A.②⑦B.②⑤⑦C.①③④D.②⑤⑥⑦
【答案】A
【解析】
可逆反应A(气)+3B(气)2C(气)+2D(固)达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化;注意生成物D是固体,反应两边气体的质量不相等,据此进行判断。
①C的生成速率与C的分解速率相等,说明正逆反应速率相等,该反应达到了化学平衡状态,故①不选;
②单位时间内生成amolA,同时生成3amolB,表示的都是逆反应速率,无法判断正逆反应速率是否相等,无法判断是否达到了平衡状态,故②选;
③A、B、C的浓度不再变化,说明正逆反应速率相等,反应达到了平衡状态,故③不选;
④A、B、C的分压强不再变化,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,故④不选;
⑤混合气体的总压强不再变化,反应方程式两边气体的化学计量数之和不相等,总压强不再变化,说明各组分的浓度不变,正逆反应速率相等,达到了平衡状态,故⑤不选;
⑥反应两边气体的体积不相同,混合气体的物质的量是个变化的量,混合气体的物质的量不再变化,说明正逆反应速率相等,达到了平衡状态,故⑥不选;
⑦单位时间内消耗amolA,同时生成 3amolB,说明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故⑦不选;
⑧A、B、C、D的分子数之比为1:3:2:2,不能判断各组分的分子数是否不再变化,无法判断是否达到平衡状态,故⑧选;
故答案为A。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
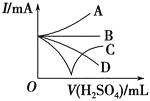
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。