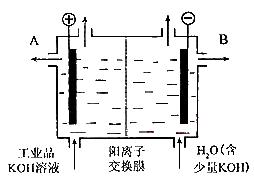
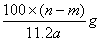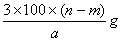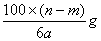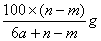题目内容
甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时, (14分)
(14分)
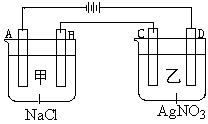
(1)写出电极名称和电极反应式:
A
B
C
D
(2)在A、D电极上生成的气体物质的量之比为:_____________
 (14分)
(14分)
(1)写出电极名称和电极反应式:
A
B
C
D

(2)在A、D电极上生成的气体物质的量之比为:_____________

略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目