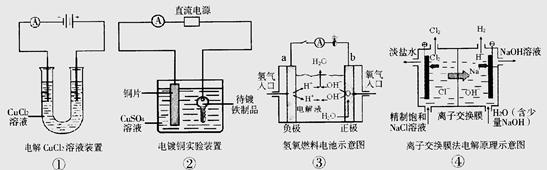
题目内容
在水中加入等物质的量的Ag+、Ba2+、SO42-、NO3-、Cl-、Na+,用惰性材料作电极进行电解,通电片刻后停止,下列说法不正确的是( )
| A.电解的实质是:阳极:2Cl--2e-====Cl2↑;阴极:Ag+e-====Ag |
| B.电解的实质是:阳极:4OH--4e-====2H2O+O2↑;阴极:2H++2e-====H2↑ |
| C.要恢复成电解前的溶液可以加水 |
| D.电解产物中氧化产物和还原产物的物质的量之比为1∶2 |
A
由原溶液中Ag+与Cl-、Ba2+与SO42-均全部沉淀,故溶液其实是NaNO3溶液,根据放电顺序可知:阳极:4OH--4e-==2H2O+O2↑;阴极:2H++2e-==H2↑,氧化产物氧气和还原产物氢气的物质的量之比为1∶2;相当于电解水,恢复成电解前的溶液可以加水即可;
故答案为A
故答案为A

练习册系列答案
相关题目

 g
g 四
四 个实验,你认为可行的方案是
个实验,你认为可行的方案是 
 (14分)
(14分)