题目内容
【题目】实验小组探究碳与浓硝酸的反应,进行下表中的实验:
实验操作 | 实验现象 |
a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 | / |
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)能证明浓硝酸表现氧化性的实验现象是___。
(2)反应产生的热量会使少量浓硝酸发生分解反应,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是___。
(3)实验现象中液面上木炭迅速燃烧,发出光亮。甲同学认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验验证猜想。
Ⅰ.制取NO2气体

①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
②NaOH溶液的作用是处理尾气,该反应生成两种物质的量相等的正盐,反应的化学方程式为___。
Ⅱ.木炭在NO2气体中燃烧。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式___。
②分析是否需要增加带火焰的木炭与纯净的X气体反应的实验并说明理由:___。
③由上述实验推断“液面上木炭迅速燃烧,发出光亮”的现象产生的原因为:___。
【答案】有大量红棕色气体生成 O2 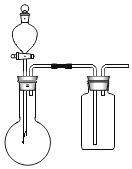 2NO2+2NaOH=NaNO2+NaNO3+H2O 2NO2+2C
2NO2+2NaOH=NaNO2+NaNO3+H2O 2NO2+2C![]() N2+2CO2 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验 主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应
N2+2CO2 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验 主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应
【解析】
(1)碳与浓硝酸的反应中,碳被氧化为二氧化碳,浓硝酸中的氮被还原为二氧化氮,据此推断,浓硝酸被还原为二氧化氮红棕色气体;
(2)浓硝酸受热分解,产生红棕色气体应为二氧化氮,根据氧化还原反应的原理可知,氮的化合价降低,则氧的化合价升高,结合产生一种无色无味的单质气体可知该气体为氧气,据此答题;
(3)|①铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图;NaOH溶液与NO2反应生成两种物质的量相等的正盐为硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式;
II.①木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式;
②木炭在NO2气体中持续燃烧,火焰迅速变亮,本身就能说明碳与NO2气体能发生反应,另外在反应过程中体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,据此答题;
③液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面.上方均存在,据此答题。
(1)碳与浓硝酸的反应中,碳被氧化为二氧化碳,浓硝酸中的氮被还原为二氧化氮,能证明浓硝酸表现氧化性的实验现象是,有大量红棕色气体生成,故答案为:有大量红棕色气体生成;
(2)浓硝酸受热分解,产生红棕色气体应为二氧化氮,根据氧化还原反应的原理可知,氮的化合价降低,则氧的化合价升高,结合产生一种无色无味的单质气体可知该气体为氧气,故答案为:O2;
(3)Ⅰ![]() 铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图为
铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图为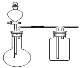 ,NaOH溶液的作用是吸收多余的NO2,NaOH溶液与NO2反应生成两种物质的量相等的正盐硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
,NaOH溶液的作用是吸收多余的NO2,NaOH溶液与NO2反应生成两种物质的量相等的正盐硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
故答案为: ;2NO2+2NaOH=NaNO2+NaNO3+H2O;
;2NO2+2NaOH=NaNO2+NaNO3+H2O;
Ⅱ![]() 木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式为:2NO2+2C
木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式为:2NO2+2C![]() N2+2CO2,故答案为:2NO2+2C
N2+2CO2,故答案为:2NO2+2C![]() N2+2CO2;
N2+2CO2;
![]() 因为在反应过程中体系中有NO2气体存在,所以氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,
因为在反应过程中体系中有NO2气体存在,所以氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,
故答案为:当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验;
![]() 液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面上方均存在,
液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面上方均存在,
故答案为:主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应。