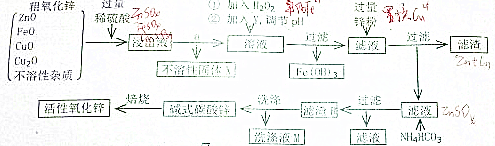
题目内容
19.向100mL 2mol•L-1AlCl3溶液中,加入200mLNa0H溶液,充分反应后,得7.8gAl(OH)3沉淀,求NaOH溶液的物质的量浓度可能是多少mol•L-1?分析 100mL 2mol/L的AlCl3溶液中氯化铝的物质的量为0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量为0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算NaOH溶液的物质的量的浓度.
解答 解:100mL 2mol/L的AlCl3溶液中氯化铝的物质的量为0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量为0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.1mol×3=0.3mol,则c(NaOH)=$\frac{0.3mol}{0.2L}$=1.5mol/L,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol (0.2-0.1)mol
则消耗的碱的物质的量为0.6mol+(0.2-0.1)mol=0.7mol,则c(NaOH)=$\frac{0.7mol}{0.2L}$=3.5mol/L,
答:需要加入氢氧化钠的物质的量难度为1.5mol/L或3.5mol/L.
点评 本题考查方程式的有关计算,为高频考点,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算,注意氢氧化铝的两性,侧重分析与计算能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CaCO3和足量盐酸反应 | |
| B. | Na2CO3溶液和足量醋酸(CH3COOH)反应 | |
| C. | Na2CO3溶液和足量稀硝酸反应 | |
| D. | NaHCO3溶液和足量稀硫酸反应 |
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 分离乙醇和乙酸混合物 | 蒸馏烧瓶、冷凝管、酒精灯、温度计、锥形瓶 | 乙醇和乙酸混合物 |
| B | 鉴别NH4Cl中的阳离子 | 试管、酒精灯 | NH4Cl、红色石蕊试纸、蒸馏水 |
| C | 实验室制取CO2 | 试管、带导管的橡皮塞 | 大理石、稀H2SO4 |
| D | 测定FeSO4溶液浓度 | 滴定管、锥形瓶、烧杯 | FeSO4溶液、0.1000mol•L-1KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na+、Fe2+、NO3-、H+ | B. | K+、Cu2+、NO3-、H+ | ||
| C. | H+、Na+、NO3-、HCO3- | D. | NH4+、Fe2+、NO3-、OH- |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2),反应需向正方向进行才能达到新的平衡.
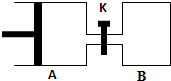 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答: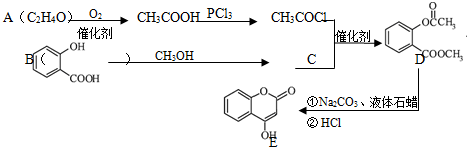
 .
.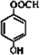 .
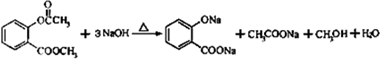
.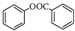 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: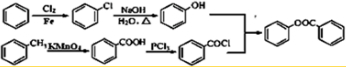 .
.