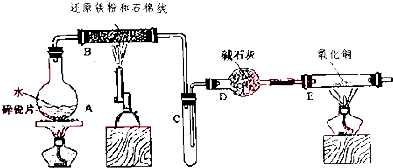
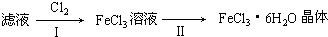题目内容
6.室温下,在pH=13的某溶液中,由水电离出的c(OH-)为( )①1.0×10-7mol/L②1.0×10-6mol/L③1.0×10-1mol/L④1.0×10-13mol/L.
| A. | ③ | B. | ③或④ | C. | ①或③ | D. | ④ |
分析 室温时,Kw=1×10-14,c(H+)×c(OH-)=1×10-14;室温下,在pH=13的某溶液显碱性,此溶液可能是碱溶液,也可能是强碱弱酸盐溶液,分类讨论.
解答 解:室温下,Kw=1×10-14,c(H+)×c(OH-)=1×10-14,在pH=13的某碱溶液中,溶液中的氢离子只有水电离的,氢离子浓度为:c(H+)=1×10-13mol/L,所以水电离的氢氧根离子浓度为:c(OH-)=c(H+)=1×10-13mol/L,故④正确;
若为强碱弱酸盐溶液,在盐溶液中,所有的氢离子和氢氧根均来自于水的电离,但由于弱酸根离子的水解,将水电离出的氢离子结合弱酸根离子一部分,故溶液中的氢氧根才能代表水电离出的全部氢氧根离子,故水电离出的c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-13}}$mol/L=1.0×10-1mol/L,故③正确;
故选B.
点评 本题考查了PH的简单计算和水的电离氢氧根浓度的计算,应注意的是碱性溶液不一定是碱溶液,还可能是能水解的盐溶液,题目难度不大.

练习册系列答案
相关题目
16.下列含有极性键的非极性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF.
| A. | ②③④⑤⑧ | B. | ①③④⑤⑧ | C. | ①③④⑧ | D. | 以上均不对 |
17.可选家发现了一种新型氢分子,其分子式为H3,关于原子个数相同的H3和H2,下列说法中一定正确的是( )
| A. | 体积一定相等 | B. | 分子数一定相等 | ||
| C. | 质量一定相等 | D. | 物质的量一定相等 |
1.今有A、B两种原子,B原子的电子总数比A原子的电子总数的两倍多一个,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是( )
| A. | Si和Al | B. | N和P | C. | F和Cl | D. | C和Al |
11.下列仪器或装置在使用前需要检查气密性的是( )
| A. | 容量瓶 | B. | 蒸馏烧瓶 | C. | 分液漏斗 | D. | 酸(碱)式滴定管 |
18.将100mL 0.1mol/L K2CO3溶液与pH=13的Ba(OH)2溶液等体积混合,要使其滤液的pH=7,应加入1mol/L盐酸的体积为( )
| A. | 10mL | B. | 20mL | C. | 40mL | D. | 60mL |