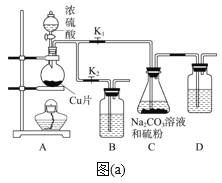
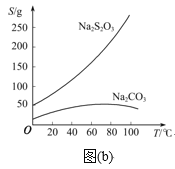
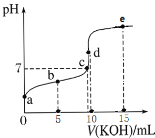
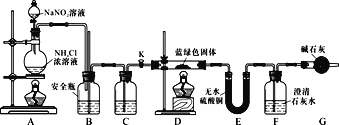
题目内容
【题目】含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
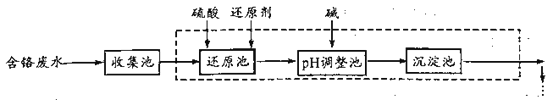
(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________。
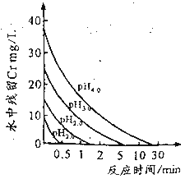
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________。
(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Kap(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________
【答案】2CrO42-+2H+![]() Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
【解析】
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂;
(4)由溶度积计算可得;Ba2+在溶液中有毒。
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,转化的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道,所以实际生产中需控制pH=2.5~3.0,故答案为:溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂,使Cr(OH)3更好地沉淀,故答案为:加入絮凝剂;
(4)达到废水排放标准时,CrO42-的浓度为![]() =
=![]() mol/L,则溶液中Ba2+浓度为
mol/L,则溶液中Ba2+浓度为![]() =
=![]() =6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。
=6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案