题目内容
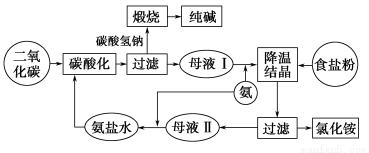
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O=NH4HCO3
NaCl+NH4HCO3=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
(3)“联合制碱法”中的CO2来源于合成氨厂,“氨碱法”中的CO2来源于煅烧石灰石
(4)  ×100%=49.77%
×100%=49.77%
【解析】氨碱法的原料:氯化钠、碳酸钙(或二氧化碳)及氨。
工艺流程:CaCO3 CaO+CO2↑CO2+NH3+H2O=NH4HCO3,
CaO+CO2↑CO2+NH3+H2O=NH4HCO3,
NaCl+NH4HCO3=NaHCO3↓+NH4Cl,2NaHCO3 Na2CO3+H2O↑+CO2↑,
Na2CO3+H2O↑+CO2↑,
CaO+H2O=Ca(OH)2,
产生CaCl2的反应:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。
CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。
联合制碱法:NH3和CO2来源于合成氨厂
工艺流程:NH3+CO2+H2O=NH4HCO3,
NaCl+NH4HCO3=NaHCO3↓+NH4Cl,
2NaHCO3 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。

依据总反应:2NaCl+CO2+H2O+2NH3=Na2CO3+2NH4Cl
可得:原子利用率= ×100%=49.77%。
×100%=49.77%。

 精英口算卡系列答案
精英口算卡系列答案