题目内容
14.(1)25℃、101kPa时,2g乙醇完全燃烧生成CO2和液态水,同时放出59.4 kJ热量,写出该反应的热化学方程式C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.2kJ/mol.(2)有等体积、等pH的Ba(OH)2和NH3•H2O两种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2,则V1<V2 (填“>”、“<”或“=”)
(3)化学电池在通讯、交通及日常生活中有着广泛的应用.目前常用的镍-镉(Ni-Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O$?_{放电}^{充电}$2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,
以下说法中正确的是B
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③B.②④C.①④D.②③
②废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值.在酸性土壤中这种污染尤为严重.这是因为Ni(OH)2和Cd(OH)2能溶于酸性溶液.
分析 (1)2g乙醇的物质的量=$\frac{2g}{46g/mol}$=$\frac{1}{23}$mol,2g乙醇完全燃烧生成CO2和液态水,同时放出59.4 kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量为=-1366.2kJ,据此书写热化学方程式;
(2)pH相等的氢氧化钡和氨水,氨水浓度大于氢氧化钡2倍,滴加等浓度稀盐酸中和,需要盐酸体积与碱的物质的量成正比;
(3)①相同条件下既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应;
原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;
②酸性条件下,Ni(OH)2和Cd(OH)2都能溶解生成重金属盐.
解答 解:(1)2g乙醇的物质的量=$\frac{2g}{46g/mol}$=$\frac{1}{23}$mol,2g乙醇完全燃烧生成CO2和液态水,同时放出59.4 kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量为=-1366.2kJ,所以其热化学方程式为C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.2 kJ/mol,
故答案为:C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.2 kJ/mol;
(2)pH相等的氢氧化钡和氨水,氨水浓度大于氢氧化钡2倍,pH相同、体积相同的氢氧化钡和氨水,氨水物质的量大于氢氧化钡二倍,滴加等浓度稀盐酸中和,需要盐酸体积与碱的物质的量成正比,所以V1<V2,
故答案为:<;
(3)①相同条件下既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应;
原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;
该反应正逆反应条件不同,所以不是可逆反应;
放电时是将化学能转化为电能,充电时是将电能转化为化学能,
故选B;
②酸性条件下,Ni(OH)2和Cd(OH)2都能溶解生成重金属盐,重金属盐能使人产生中毒,从而影响人体健康,所以酸性土壤中这种污染尤为严重,故答案为:Ni(OH)2和Cd(OH)2能溶于酸性溶液.
点评 本题考查原电池和电解池原理、热化学方程式书写、弱电解质电离等知识点,侧重考查分析、计算能力,注意反应热与化学计量数有关,题目难度不大.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案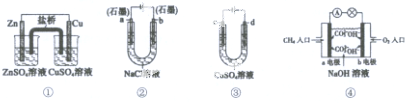
| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |
| A. | 某原子K层上只有一个电子 | |
| B. | 某离子L层和M层上的电子数均为K层的4倍 | |
| C. | 某离子M层上的电子数为L层上的4倍 | |
| D. | 某离子的核电荷数与最外层电子数相等 |
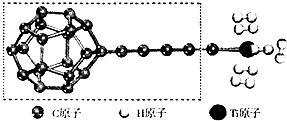 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型有3种.
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心.由钾、镁、氟形成的该化合物的化学式为KMgF3,每个K+与12个F-配位.
| A. | 分子组成相同的化合物 | B. | 分子构造相同的化合物 | ||
| C. | 分子组成相同而构造不同的化合物 | D. | 分子组成与构造都不相同的化合物 |
| A. | 焰色反应均应透过蓝色钴玻璃观察 | |
| B. | NaC1与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应是化学变化 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |
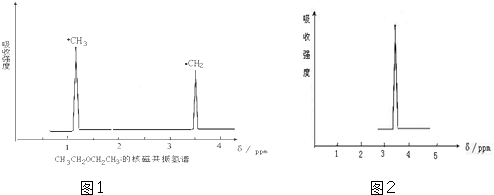
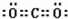 ;
;