题目内容
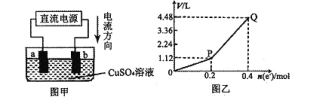
【题目】下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A. A处通入空气,B处通入水煤气
B. a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C. a电极发生还原反应,b电极发生氧化反应
D. 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
【答案】D
【解析】
A.电子的流向可知,电子从a极出来,回到b极。所以a是负极(燃料失电子),b极是正极(O2得电子)。故A错误;
B.负极电极反应式:不仅CO失电子,还有H2失电子。CO失电子后变成+4价(以CO2形式存在)而电解质溶液是碱性溶液,所以CO2会与OH-发生反应生成CO32-。故电极反应为:CO+4OH--2e-= CO32-+2H2O。配平时不仅满足电子守恒,还有电荷守恒和原子守恒。同理可写出H2的反应:H2+2OH--2e-=2H2O。所以漏了H2的反应式。故B错误;
C.a电极是负极,发生氧化反应。b电极是正极,得到电子,发生还原反应。故C错误;
D.如用这种电池电镀铜,当镀件增重6.4gCu,说明n(Cu)=0.1mol。转移n(e-)=0.2mol。1molCO转移2mol e-,1mol H2转移2mol e-。1molCO和H2的混合气体也是转移2mol e-。现增重6.4gCu,转移0.2mol e-,所以消耗CO 0.1mol或0.1mol H2或CO和H2的混合气体0.1mol。故D正确。
答案选D。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过![]() 和
和![]() 化合来制备甲醇。已知某些化学键的键能数据如下表:
化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 |
|
|
|
|
|
键能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 与
与![]() 之间为三键,则工业制备甲醇的热化学方程式为________。
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为![]() 的密闭容器内充入
的密闭容器内充入![]() 和
和![]() ,加入合适催化剂(体积可以忽略不计),在
,加入合适催化剂(体积可以忽略不计),在![]() 时开始反应,并用压力计监测容器内压强的变化如下表:
时开始反应,并用压力计监测容器内压强的变化如下表:
反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到![]() 时,以
时,以![]() 表示的平均反应速率
表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ________
________![]() ,若升高温度,则
,若升高温度,则![]() 值________(填“增大”“减小”或“不变")。
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,反应温度对
下,反应温度对![]() 平衡转化率影响的曲线。
平衡转化率影响的曲线。

①曲线![]() 对应的投料比为________。
对应的投料比为________。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,对应的反应温度与投料比的关系是________。
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,平衡混合气中
时,平衡混合气中![]() 的物质的量分数是________(精确到
的物质的量分数是________(精确到![]() )。
)。
【题目】碘在科研与生活中有重要应用,某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-= 2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的___耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为n(S2O32-)∶n(S2O82-)___。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx__mL,理由是___。
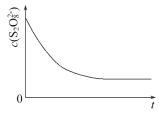
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)____