题目内容
短周期主族元素W、X、Y、Z位于同一周期,且原子序数依次增大。W、X是金属元素,Y、Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是
| A.W2Y溶液显中性 |
| B.W与Z形成的化合物中不含有离子键 |
| C.1mol元素Z的单质与足量的W的最高价氧化物对应的水化物的溶液反应,转移1mol电子 |
| D.W、X的单质通常是电解其氧化物得到 |
C
解析试题分析:W、X是金属元素,W、X的最高价氧化物对应的水化物应为碱,可以相互反应,说明一种为两性氧化物,应为Al(OH)3,则W为Na,X为Al,Y的最外层电子数是核外电子层数的2倍,且与Na、Al在同一周期,应为S元素,Z的原子序数最大,主族元素,只有Cl元素符合。由此:A、W2Y为Na2S,硫离子水解使溶液显碱性,A错误;B、W与Z形成的化合物是NaCl,含有离子键,B错误;C、Z的单质(Cl2)与足量的W的最高价氧化物对应的水化物(NaOH)的溶液反应,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故1mol Cl2转移1mol电子,C正确;D、Na为电解NaCl得到,Al为电解氧化铝得到,D错误。
考点:考查元素周期表和周期律的相关知识。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.离子半径:X2->Y+>Z- | D.原子序数:X>Y>Z |
下图是元素周期表短周期的一部分,Y、W的质子数之和为25。下列说法正确的是
| | X | | Y |
| Z | | W | |
A.非金属性:W>Z
B.原子半径:X<Y
C.Z的最高价氧化物可溶于Y的氢化物的水溶液
D.Y的最高价氧化的水化物酸性强于W最高价氧化的水化物
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是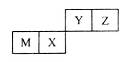
| A.Y元素气态氢化物的稳定性大于Z元素的 |
| B.M和Y两种元素,可以形成电子层结构相同的两种简单离子 |
| C.X元素最高价氧化物对应水化物的酸性弱于Y元素的 |
| D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应 |
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
| A.10Be和9Be是中子数不同质子数相同的不同原子 |
| B.10Be的原子核内中子数比质子数多 |
| C.5.2 g26Al3+中所含的电子数约为1.2×1024 |
| D.26Al和26Mg的质子数、中子数和核外电子数都不相同 |
下列物质的性质比较,正确的是
| A.酸性:H2SO4>HClO4>HBrO4 | B.碱性:NaOH>KOH>RbOH |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>H2O>PH3 |
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是( )
| A.X的单质固态时为分子晶体 | B.Y的单质可以形成原子晶体 |
| C.X与Y形成的化合物固态时为分子晶体 | D.X与碳形成的化合物为分子晶体 |
镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
| A.在化合物中呈+2价 | B.单质能与水反应放出氢气 |
| C.镭比钙的金属性弱 | D.碳酸镭难溶于水 |
下列化合物中,阴离子和阳离子的半径之比最大的是 ( )
| A.CsI | B.NaF | C.LiI | D.KCl |