题目内容
16.下列表述正确的是( )| A. | 少量的CO2通入BaCl2溶液中会产生白色沉淀 | |
| B. | 向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 | |
| C. | NO2和水反应时,NO2作氧化剂,水作还原剂 | |
| D. | SO2能使酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 |
分析 A.少量的CO2通入BaCl2溶液中,不反应;
B.氯水中存在Cl2+H20?HCl+HClO,加碳酸钙与盐酸反应,平衡正向移动;
C.NO2和水反应生成硝酸和NO;
D.SO2能使酸性高锰酸钾溶液褪色,发生氧化还原反应.
解答 解:A.盐酸的酸性大于碳酸,则少量的CO2通入BaCl2溶液中不反应,故A错误;
B.氯水中存在Cl2+H20?HCl+HClO,加碳酸钙与盐酸反应,平衡正向移动,则HClO的浓度增大,故B正确;
C.NO2和水反应生成硝酸和NO,NO2即作氧化剂又作还原剂,故C错误;
D.SO2能使酸性高锰酸钾溶液褪色,发生氧化还原反应,S元素的化合价升高,则体现二氧化硫的还原性,故D错误;
故选B.
点评 本题考查物质的性质,综合考查元素化合物知识,把握物质的性质、发生的反应、平衡移动原理、氧化还原反应等为解答的关键,注重性质与反应原理的结合,题目难度不大.

练习册系列答案
相关题目
6.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | Na2O2 | B. | CaO | C. | FeCl2 | D. | SiO2 |
7.将4mol金属Al全部转化为Al(OH)3,共消耗HClamol,NaOHbmol,则(a+b)的最小值为( )
| A. | 4mol | B. | 6mol | C. | 8mol | D. | 16mol |
11.下列关于氧化物的叙述正确的是( )
| A. | 金属氧化物都是碱性氧化物 | |
| B. | 与水反应可生成含酸的氧化物都是酸性氧化物 | |
| C. | 酸性氧化物都可以与强碱反应 | |
| D. | 不能跟酸反应的氧化物一定能和碱反应 |
8.下列反应中,不属于四种基本反应类型的是( )
| A. | 2Na+2H2O═2NaOH+H2 | B. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | ||
| C. | Fe+2FeCl3═3FeCl2 | D. | 2HCl$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ |
5.下列图示与对应的叙述相符的是( )
| A. |  由图可以判断:若T1>T2,反应A(g)+B(g)?2C(g)的△H<0 | |
| B. |  图表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. |  根据图,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. |  图表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
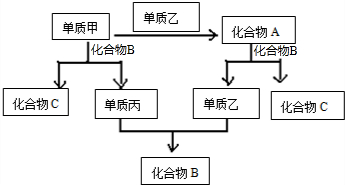 A、B、C三种化合物,其中化合物A为淡黄色固体,甲、乙、丙是三种单质,上述单质和化合物之间存在如图反应关系,据此推断:
A、B、C三种化合物,其中化合物A为淡黄色固体,甲、乙、丙是三种单质,上述单质和化合物之间存在如图反应关系,据此推断: