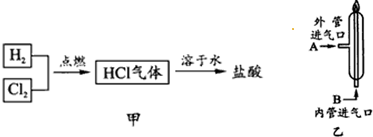
题目内容
9.下列化学反应的离子方程式其中正确的是( )| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ |
分析 A.碳酸钙为难溶物,在离子方程式中不能拆开;
B.氨水为弱碱,一水合氨不能拆开;
C.氢离子、氢氧根离子的系数与硫酸、氢氧化钡的化学式不相符;
D.铁与铁离子反应生成亚铁离子.
解答 解:A.碳酸钙与盐酸反应中,碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氨水与盐酸反应生成氯化铵,一水合氨需要保留化学式,正确的离子方程式为:NH3•H2O+H+=NH4++H2O,故B错误;
C.氢氧化钡溶液与硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.铁与氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 铁和稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 醋酸和氢氧化钠溶液反应 H++OH-═H2O | |
| C. | 氯气和溴化钠溶液反应 Cl2+2Br-═2Cl-+Br2 | |
| D. | 氢氧化钡溶液滴入硫酸中:Ba2++SO42-═BaSO4↓ |
17.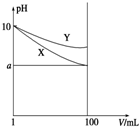 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 稀释后X溶液中水的电离程度比Y溶液中水电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液Y的pH大 | |
| C. | 若8<a<10,则X、Y都是弱碱 | |
| D. | 完全中和X,Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) |
4.下列有关化学实验的叙述正确的是( )
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |
18.相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H=a kJ•mol-1.(a>0),实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是( )
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时 体系能量的变化 | ||
| A | B | C | ||
| ① | 1 | 2 | 0 | 吸收热量:0.25akJ |
| ② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中C的体积分数均约为18% | |
| C. | 容器②中达到平衡时吸收的热量Q=0.25a kJ | |
| D. | 若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ |
19.A、B、C、D四种短周期主族元素的原子序数依次递增,A原子最外层电子数是次外层的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解熔融氧化物的方法获得D的单质,D原子的最外层电子数是B原子最外层电子数的$\frac{1}{2}$.下列说法正确的是( )
| A. | A与B形成的化合物为酸性氧化物 | |
| B. | 简单离子半径:D>B>C | |
| C. | 由这四种元素中的任意三种组成的无机盐溶于水均可促进水的电离 | |
| D. | 相同质量的C、D单质分别与足量的稀盐酸反应.前者生成的氢气更多 |

 .
.