题目内容
14.化工厂生产盐酸的主要过程如图甲所示: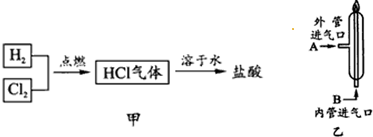
其中关键的一步为(如图乙所示)氯气和氢气在燃烧管口燃烧,生成HCl.由于氯气有毒,因此,通入气体的合理方式是:A处通入H2,B处通入Cl2,该过程涉及的操作有:①通氯气 ②通氢气 ③点燃 正确的操作顺序为②③①(填序号)
分析 氯气有毒,为保证氯气完全反应,氢气应过量,为防止氯气污染空气,应先通入氢气,以此解答该题.
解答 解:氯气有毒,为保证氯气完全反应,氢气应过量,则应从外管通入氢气,从内管通入氯气,为防止氯气污染空气,应先通入氢气,点燃后再通入氯气,故顺序为②③①,
故答案为:H2;Cl2;②③①.
点评 本题考查氯气的性质,为高频考点,侧重于化学与生产的考查,由于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
4.化学与科学、技术、社会密切相关,下列做法或说法正确的是( )
| A. | 从海带中提取碘的过程中得到碘的四氯化碳溶液,可用蒸发的方法分离出碘 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 控制雾霾需要从控制氮氧化物、二氧化硫和二氧化碳等大气污染物排放着手 |
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1g H2所含分子数为NA | |
| B. | 2g D2O中所含的质子数为NA | |
| C. | 0.5 mol/L Na2SO4溶液中所含Na+ 数为NA | |
| D. | 标准状况下,4.48 L CCl4所含原子数为NA |
2.下列指定反应的离子方程式一定错误的是( )
| A. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-=NH3•H2O+BaCO3↓+H2O | |
| B. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苏打溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3- |
9.下列化学反应的离子方程式其中正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ |
6.CO和H2在ThNi5作用下可以合成CH4.
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
| A. | 催化剂不能改变该反应的△H | |
| B. | ①中反应物的键能总和小于生成物的键能总和 | |
| C. | ②中反应物的总能量高于生成物的总能量 | |
| D. | CO(g)与H2(g)合成CH4(g)的反应为放热反应 |
3.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA个氢离子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA个OH- | |
| C. | 8.4gNaHCO3固体中含有0.1NA 个CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水电离出的H+的数目为10-3NA |