题目内容
17.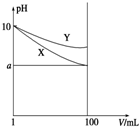 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 稀释后X溶液中水的电离程度比Y溶液中水电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液Y的pH大 | |
| C. | 若8<a<10,则X、Y都是弱碱 | |
| D. | 完全中和X,Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) |
分析 由图可知,开始的pH相同,两种碱溶液稀释后pH不同,则碱性强弱一定不同,稀释相同体积时,X的pH变化较大,而Y的pH变化较小,则说明在加水稀释时,Y进一步电离出OH-,说明电离程度Y较X小,结合题给信息和要求解答该题.
解答 解:A、由图可知,开始的pH相同,两种碱溶液稀释后pH不同,X的pH变化较大,而Y的pH变化较小,说明在加水稀释时,Y进一步电离出OH-,说明电离程度Y较X小,故A错误;
B、稀释后X的pH变化较大,则碱性X大于Y,碱性越强,其阳离子的水解程度越小,X的盐酸盐的水解程度小,所以盐酸盐溶液X的pH大,故B错误;
C、由图可知,开始的pH相同,若8<a<10,则溶液的pH在原来基础上变化小于2,说明X、Y中都存在电离平衡,是弱碱,故C正确;
D、稀释后X的pH变化较大,则碱性X大于Y,pH相同时,碱性强的溶液的物质的量浓度较小,所以溶质浓度Y大于X,完全中和X、Y两溶液时,消耗同浓度硫酸的体积V(X)<V(Y),故D错误;
故选C.
点评 本题考查学生强弱电解质的电离知识,溶液稀释时pH的变化曲线图,明确碱溶液在稀释时的PH的变化程度及相同PH时碱性强的浓度比碱性弱的浓度小是解答本题的关键.

练习册系列答案
相关题目
8.下列离子方程式中正确的是( )
| A. | 碳酸氢钡溶液与少量NaHSO4溶液反应:HSO4-+Ba2++HCO3-═BaSO4↓+H2O+CO2↑ | |
| B. | 钠和水的反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 向碳酸氢钙溶液中滴加过量的澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1g H2所含分子数为NA | |
| B. | 2g D2O中所含的质子数为NA | |
| C. | 0.5 mol/L Na2SO4溶液中所含Na+ 数为NA | |
| D. | 标准状况下,4.48 L CCl4所含原子数为NA |
12.如表内容与结论不相对应的是( )
| 内容 | 结论 | |
| A | 一个反应的△H>0,△S>0 | 反应一定不能自发进行 |
| B | 硝酸铵溶于水可自发进行 | 因为该反应的△S>0 |
| C | H2O(g)变成H2O(l) | △S<0 |
| D | H2(g)+F2(g)═2HF(g)的△H=-271kJ•mol-1,△S=+8J•mol-1•K-1 | 反应在任意温度下都能自发进行 |
| A. | A | B. | B | C. | C | D. | D |
2.下列指定反应的离子方程式一定错误的是( )
| A. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-=NH3•H2O+BaCO3↓+H2O | |
| B. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苏打溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3- |
9.下列化学反应的离子方程式其中正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ |
6.CO和H2在ThNi5作用下可以合成CH4.
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
已知温度为T时:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
②CH4(g)+2H2O(g)═4H2(g)+CO2(g)△H=+165kJ•mol-1
下列说法不正确的是( )
| A. | 催化剂不能改变该反应的△H | |
| B. | ①中反应物的键能总和小于生成物的键能总和 | |
| C. | ②中反应物的总能量高于生成物的总能量 | |
| D. | CO(g)与H2(g)合成CH4(g)的反应为放热反应 |
7.T1温度下,体积为2L的恒容密闭容器,加入4.00molX、2.00molY,发生化学反应2X(g)+Y(g)?3M(g)+N(s).部分实验数据如表格所示:
反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
| A. | 平衡不移动 | |
| B. | 重新达到平衡后,再充入的M转化率小于50% | |
| C. | 重新达到平衡后,Y的平均反应速率与原平衡相等 | |
| D. | 重新达到平衡后,用X表示的v(正)比原平衡大 | |
| E. | 重新达到平衡后,混合气体中Y的体积分数增大 | |
| F. | 重新达到平衡后,M的物质的量浓度是原平衡的1.5倍 |
