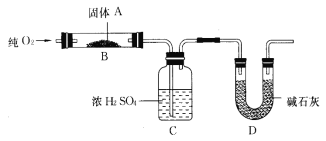
题目内容
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) △H<0。反应过程中测定的数据如下表:
2Z(g) △H<0。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请计算:
(1)反应前2 min的平均速率ν(Z) = __________________________,
(2)到达平衡时,X的转化率为_______________________。
【答案】0.004mol/(L·min)37.5%
【解析】
(1)2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)=0.04mol÷10L÷2min=0.002mol/(Lmin),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),故答案为0.004mol/(L·min);(2)由表格中数据可知反应进行7min后,Y的物质的量不在发生变化,说明反应已达平衡,此时转化的n(Y)=n(X)=0.16mol-0.1mol=0.06mol,则X的转化率为0.06÷0.16=37.5%,故答案为37.5%。

练习册系列答案
相关题目
【题目】下列关于物质分类的正确组合是( )
混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
C | 水煤气 | CuO | HCl | NH3 . H2O | CaF2 |
D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
A.A
B.B
C.C
D.D