题目内容
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅰ:在2支试管中分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表1:
[表1]
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
[表2]
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
[表3]
(1)实验Ⅰ得出的结论是_____。
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利[
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
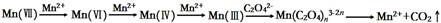
上述实验中,实验_____可证明这个历程是可信的。
实验Ⅰ:在2支试管中分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30 s | 2 s |
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100 s | 90 s |
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1 mL稀硫酸的试管 | 加入2 mL稀硫酸的试管 |
| 褪色时间 | 70 s | 100 s | 120 s |
(1)实验Ⅰ得出的结论是_____。
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利[
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
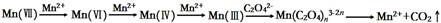
上述实验中,实验_____可证明这个历程是可信的。
(1)Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率。(2)①②③;
(3)5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O; 从无色变为浅紫红色;偏大(4)Ⅰ;
(3)5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O; 从无色变为浅紫红色;偏大(4)Ⅰ;
试题分析:(1)未加MnSO4的试管褪色需要30 s,加MnSO4的试管褪色需要2 s.说明Mn2+能够加快反应速率。在反应中起到催化剂的作用。(2)加入10滴稀硫酸的试管在室温下褪色需要90s,放置在温度为65℃的水浴中加热的褪色时间需要70s,说明温度对该反应速率有影响;在室温下未滴加稀硫酸的试管褪色需要100 s,滴加稀硫酸的试管褪色需要90s。说明硫酸对草酸和KMnO4溶液的反应有影响;同样放置于温度为65℃的水浴中分别加入10滴稀硫酸加热,加入1 mL稀硫酸加热,加入2 mL稀硫酸加热,褪色时间分别是70s、 100s、 120s,则说明加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小;在酸性条件下,溶液的酸性越小,对反应越有利,溶液的酸性越大,对反应反而不利。结论正确的是①②③。(3)草酸溶液与酸性KMnO4溶液发生氧化还原反应的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;在滴定时通常是用已知浓度的物质来滴定未知浓度的物质。所以未知浓度H2C2O4在锥形瓶中,已知浓度的KMnO4在酸式滴定管中。滴定终点时溶液的颜色从无色变为浅紫红色,且在半分钟内不褪色。在滴定完成后若仰视读取KMnO4溶液,则KMnO4标准溶液体积偏大,以此为标准进行计算求出的草酸的浓度就会偏大。(4)实验Ⅰ是证明Mn2+对反应的催化作用。实验Ⅱ是证明溶液的酸碱性对反应的影响。实验Ⅲ是证明温度对反应的影响。通过这些分析可知实验Ⅰ可证明这个历程是可信的。2C2O4)溶液与酸性KMnO4溶液反应的影响的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是 2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是 CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是