��Ŀ����
��֪��Ӧ��2SO2(g)+ O2(g)  2SO3(g)��H<0��ij�¶��£���2mol SO2��1mol O2��
2SO3(g)��H<0��ij�¶��£���2mol SO2��1mol O2��
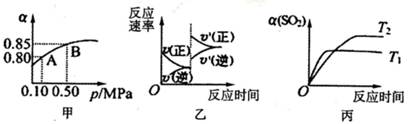
��10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����
ʾ��������˵����ȷ����
 2SO3(g)��H<0��ij�¶��£���2mol SO2��1mol O2��
2SO3(g)��H<0��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����
ʾ��������˵����ȷ����

| A����ͼ���ƶϣ�B��SO2��ƽ��Ũ��Ϊ0.3mol��L-1 |
| B����ͼ���ƶϣ�A���Ӧ�¶��µ�ƽ�ⳣ��Ϊ80 |
| C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2>Tl |
C
���������A��B��SO2��ƽ��Ũ��Ϊ2����1��0.85����10="0.03" mol��L-1������
B�� 2SO2(g)+ O2(g)
 2SO3(g)
2SO3(g)ʼ�� 2 1
ת���� 1.6 0.8 1.6
ƽ���� 0.4 0.2 1.6
ƽ�ⳣ��k=0.162/0.042��0.02=800������
C����ƽ�����С�����ݻ�������ѹǿƽ�������ƶ�������Ӧ���ʴ����淴Ӧ�����Ҿ���ԭ������ȷ��D��Tl��Ӧ���ʿ죬�¶ȸߣ�����

��ϰ��ϵ�д�
�����Ŀ
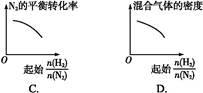
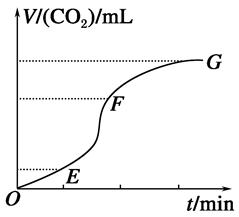
 CO(g)��3H2(g)��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������жϲ���ȷ���ǣ� ��
CO(g)��3H2(g)��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������жϲ���ȷ���ǣ� ��
 3Z(g)��H��0����Ӧ���̳��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����
3Z(g)��H��0����Ӧ���̳��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����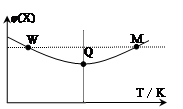
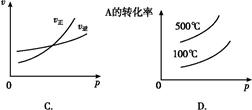
 2C(g)����H<0 ����ȷͼ������ͼ�е�(����)
2C(g)����H<0 ����ȷͼ������ͼ�е�(����)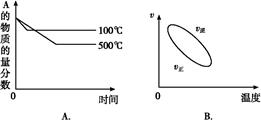
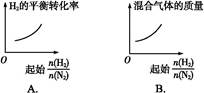
 2NH3��
2NH3��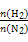 ��ʾ��ʼʱH2��N2�����ʵ���֮��,����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ���ǣ� ��
��ʾ��ʼʱH2��N2�����ʵ���֮��,����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ���ǣ� ��