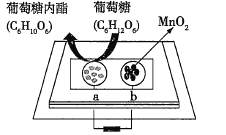
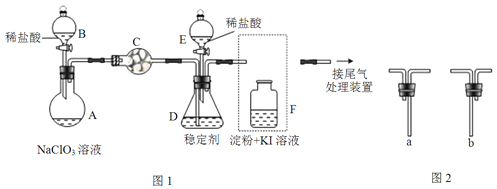
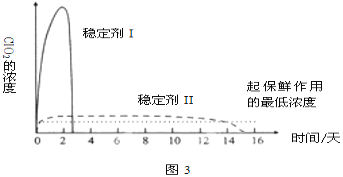
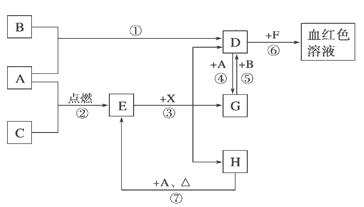
题目内容
【题目】为测定某样品中所含晶体FeSO47H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.2000molL-1KMnO4溶液20.00mL,所得晶体中FeSO47H2O的质量分数为__(用a表示)。
【答案】![]()
【解析】
根据元素守恒和电子守恒,即5FeSO47H2O~KMnO4,计算FeSO47H2O的质量分数,由此分析解答。
亚铁离子会被高锰酸钾氧化为三价铁离子,KMnO4被还原为+2价的锰离子,根据电子守恒,即5FeSO47H2O~KMnO4,根据消耗0.2000molL-1KMnO4溶液20.00mL,所以晶体中FeSO47H2O的质量分数= 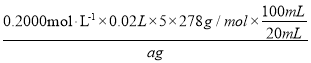 ×100%=
×100%=![]() 。
。

【题目】汽车尾气中含有CO、NO等有害气体。
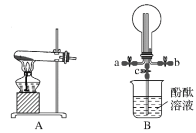
(1)通过NO传感器可监测汽车尾气中NO的含量其工作原理如图所示。已知:![]() 可在固体电解质中自由移动。
可在固体电解质中自由移动。
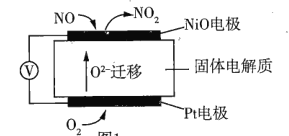
①NO电极上发生的是______(填“氧化”或“还原”)反应。
②外电路中,电子是从______(填“NO”或Pt”)电极流出。
③Pt电极上的电极反应式为______。
(2)一种新型催化剂用于NO和CO的反应:![]() 。已知增大催化剂的比表面积可提高该反应的速率,为了验证温度、催化剂的比表面积对化学反应速率的影响,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高该反应的速率,为了验证温度、催化剂的比表面积对化学反应速率的影响,某同学设计了三组实验,如表所示。
实验编号 |
| NO初始浓度/( | CO初始浓度/( | 催化剂的比表面积( |
Ⅰ | 280 |
|
| 82 |
Ⅱ | 280 |
|
| 124 |
Ⅲ | 350 | a |
| 82 |
①表中a=______。
②能验证温度对化学反应速率影响的是实验______(填实验序号)。
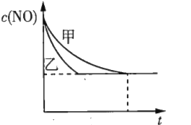
③实验I和实验Ⅱ中,NO的物质的量浓度![]() 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
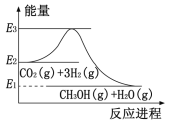
(3)在容积固定的绝热容器中发生反应![]() ,不能说明该反应已达到平衡状态的是______(填序号)。
,不能说明该反应已达到平衡状态的是______(填序号)。
A.容器内温度不再变化 B.容器内的气体压强保持不变
C.![]() D.容器内混合气体的密度保持不变
D.容器内混合气体的密度保持不变