题目内容
氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是( )
| A.一个16O原子的质量为16 g |
| B.17O的相对原子质量约为17 |
C.氧元素的相对原子质量为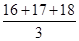 |
| D.氧元素的相对原子质量为(16a%+17b%+18c%) |
B
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是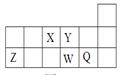
| A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)> r(Z3+) |
| B.若存在简单阴离子R2-,则R不一定与Y、W同主族 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是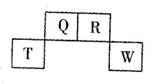
| A.气态氢化物稳定性:R>Q |
B.元素T的离子结构示意图为 |
| C.与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 |
| D.Q可形成多种含氧酸 |
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z<M |
| B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2 |
| C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种 |
| D.X与Y可形成含有非极性共价键的共价化合物 |
若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )。
| A.此X元素的气态氢化物的化学式为HX,在常温下很稳定 |
| B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2 |
| C.其单质的分子式为X2,易溶于有机溶剂 |
| D.AgX是一种有色的易溶于水的化合物 |
下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③⑤ | C.②④⑤⑥⑦ | D.②④⑥ |
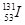 是常规核裂变物之一,可以通过测定大气或水中
是常规核裂变物之一,可以通过测定大气或水中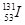 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关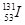 的叙述中错误的是( )
的叙述中错误的是( )
A.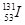 的化学性质与 的化学性质与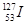 相同 相同 |
B.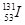 的原子序数为53 的原子序数为53 |
C.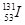 的原子核外电子数为78 的原子核外电子数为78 |
D.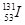 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
下列说法中正确的是( )
| A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
| B.最外层电子数相同的元素一定属于同一族 |
| C.非金属元素的最外层电子数都大于等于4 |
| D.同周期元素的电子层数相同 |