题目内容
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z<M |
| B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2 |
| C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种 |
| D.X与Y可形成含有非极性共价键的共价化合物 |
C
解析试题分析:在短周期原子序数依次增大的主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍,则W为C元素;X和Z的A2B型氢化物均为V形分子,则X为O元素;Z为S元素;Y的+1价离子比M的-1价离子少8个电子。则Y为Na元素,M为Cl元素。A.在元素周期表中,同周期的元素,原子序数越大,原子半径越小;在不同周期的元素中,原子核外的电子层数越多,原子半径越大。所以这几种元素的原子半径大小关系为:Na>S>Cl>C >O。B.由这些元素形成的三原子分子中,空间结构为直线形的有CO2,CS2,而SO2则为V型分子。C.元素C、H形成的1﹕1的化合物有C2H2、C6H6、C8H8等。正确。D.Na、O两元素可以形成Na2O、Na2O2两种化合物,它们都是离子化合物。错误。
考点:考查元素的推断及原子半径、化合物的性质与结构的知识。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
| A.用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体 |
| B.化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 |
| C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是( )
| A.一个16O原子的质量为16 g |
| B.17O的相对原子质量约为17 |
C.氧元素的相对原子质量为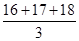 |
| D.氧元素的相对原子质量为(16a%+17b%+18c%) |
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为XYZ3W8。其中,只有W显负价。X、Y的最外层电子数之和与Z的最高正价数相等。Y3+与W的阴离子具有相同的电子层结构。X、W的质子数之和等于Y、Z的质子数之和。下列说法错误的是( )
| A.X的离子半径>Y的离子半径 |
| B.Z的氢化物稳定性<W的氢化物稳定性 |
| C.Y的氧化物既能与盐酸,又能与NaOH溶液反应 |
| D.X2W2、Y2W3两种化合物含有的化学键类型完全相同 |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到1个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
| A.原子半径:Z>Y>X |
| B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| C.Na2Y2与水发生氧化还原反应时,Na2Y2只做氧化剂 |
| D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是( )
| | X | | Y | |
| | | | W | |
| | | | | |
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
下列说法正确的是( )
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是( )
| A.原子半径:丙>乙>甲 |
| B.最外层电子数:丙=丁 |
| C.气态氢化物的稳定性:甲>丙 |
| D.最高价氧化物对应的水化物的酸性:丁>甲 |
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
| A.Z与M形成的化合物中不可能含有非极性键 |
| B.对应氢化物的热稳定性:X>Y>M |
| C.单质的还原性:R>M>Y>X |
| D.X、Y、M、Z四种元素组成的离子化合物受热易分解 |