��Ŀ����
����Ŀ��������ʡ2017����Ͼ���A����ͭ���仯������һ����Ҫ�����ʡ��ش������й����⣺
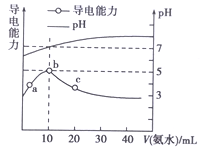
��l��ij�Թܵײ�����һ�����ܵ�ͭ�������еμ�10 mL ϡ����ʱ�������������ټ���0.1g KNO3, ���ɹ۲쵽���������ɣ�������ɹ۲쵽��������__________�����ɵ�������___���ѧʽ����
��2��ͭ��Ũ������ȷ�Ӧ��ʵ�������۲쵽�Թܵײ��к�ɫ�����γɣ���Һ����ɫ��ͨ������֪�ú�ɫ����ΪCu2S��д��Ũ������Cu��Ӧ����Cu2S�Ļ�ѧ����ʽ��___________��
��3����ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2������������ͭ�����������£��ɺϳɼ״�����֪��25�棬101kPa�£�
H2(g)+1/2O2(g)=H2O(g) ��H��-242kJ/mol��
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H��-676kJ/mol��
д��CO2��H2���ɼ״�����̬������Ȼ�ѧ����ʽ��________________��
��4���ϳɰ����յ�һ����Ҫ������ͭϴ����Ŀ������ͭҺ[���������ͭ��I������ˮ]���������������в�����̼�������ͭҺ����CO�Ļ�ѧ����ʽΪ
Cu(NH3)2Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3CO]Ac(aq�� ��H
[Cu(NH3)3CO]Ac(aq�� ��H
�� ���Ҫ���������Ӧ�ķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��______������ĸ����
a����ѹ b������NH3��Ũ�� c������Cu(NH3)2AcŨ��
d������ e����С[Cu(NH3)3CO]AcŨ��
�� �ϳɰ���Ӧ�У��ڲ�������Ӧ��������������£����ϸı䷴Ӧ��������Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��

t4��t5�ı������������__________��H2ת������ߵ�ʱ�����________����ij�¶��£�3xmolH2��xmolN2��Ӧ����1L���ܱ�������, H2�����ת����Ϊ50%������¶���2NH3(g)![]() 3H2(g)+N2(g)��ƽ�ⳣ��K=_____��������λС������
3H2(g)+N2(g)��ƽ�ⳣ��K=_____��������λС������
���𰸡�ͭ���ܽ⣬��Һ��Ϊ��ɫ NO 5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O
Cu2S+3CuSO4+4H2O
CO2(g)+3H2(g)=CH3OH(g)+H2O(g����H��-50kJ/mol abc ��Сѹǿ t0��tl 1.69x2
����������1��������Һ�����������ǿ�����ԣ��ܺͽ���ͭ��Ӧ���ɹ۲쵽���������ɣ�������ɹ۲쵽��������ͭ���ܽ⣬��Һ��Ϊ��ɫ�����ɵ�������NO����2�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪Ũ������Cu��Ӧ����Cu2S�Ļ�ѧ����ʽΪ5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O����3����֪����H2(g)+1/2O2(g)��H2O(g) ��H��-242kJ/mol����CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H��-676kJ/mol�����ݸ�˹���ɢ١�3���ڼ��ɵõ�CO2��H2���ɼ״�����̬������Ȼ�ѧ����ʽΪCO2(g)+3H2(g)=CH3OH(g)+H2O(g����H=-50kJ/mol����4����a����ѹ��Ӧ���ʼӿ죬a��ȷ��b������NH3��Ũ�ȷ�Ӧ���ʼӿ죬b��ȷ��c������Cu(NH3)2AcŨ�ȷ�Ӧ���ʼӿ죬c��ȷ��d�����·�Ӧ���ʼ�С��d����e����С[Cu(NH3)3CO]AcŨ�ȷ�Ӧ���ʼ�С��e����ѡabc���ںϳɰ���Ӧ�������С�ķ��ȷ�Ӧ��t4��t5���淴Ӧ���ʾ���С��ƽ�����淴Ӧ�����С���ı�����������Ǽ�Сѹǿ��ƽ��������Ӧ������У��������������ת���ʣ������ͼ���֪H2ת������ߵ�ʱ����� t0��tl����ij�¶��£�3xmolH2��xmolN2��Ӧ����1L���ܱ�������, H2�����ת����Ϊ50%��������������1.5xmol��������0.5xmol�����ɰ�����1.0xmol�����Ը��¶���2NH3(g)
Cu2S+3CuSO4+4H2O����3����֪����H2(g)+1/2O2(g)��H2O(g) ��H��-242kJ/mol����CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H��-676kJ/mol�����ݸ�˹���ɢ١�3���ڼ��ɵõ�CO2��H2���ɼ״�����̬������Ȼ�ѧ����ʽΪCO2(g)+3H2(g)=CH3OH(g)+H2O(g����H=-50kJ/mol����4����a����ѹ��Ӧ���ʼӿ죬a��ȷ��b������NH3��Ũ�ȷ�Ӧ���ʼӿ죬b��ȷ��c������Cu(NH3)2AcŨ�ȷ�Ӧ���ʼӿ죬c��ȷ��d�����·�Ӧ���ʼ�С��d����e����С[Cu(NH3)3CO]AcŨ�ȷ�Ӧ���ʼ�С��e����ѡabc���ںϳɰ���Ӧ�������С�ķ��ȷ�Ӧ��t4��t5���淴Ӧ���ʾ���С��ƽ�����淴Ӧ�����С���ı�����������Ǽ�Сѹǿ��ƽ��������Ӧ������У��������������ת���ʣ������ͼ���֪H2ת������ߵ�ʱ����� t0��tl����ij�¶��£�3xmolH2��xmolN2��Ӧ����1L���ܱ�������, H2�����ת����Ϊ50%��������������1.5xmol��������0.5xmol�����ɰ�����1.0xmol�����Ը��¶���2NH3(g)![]() 3H2(g)+N2(g)��ƽ�ⳣ��K��
3H2(g)+N2(g)��ƽ�ⳣ��K��![]() ��
��