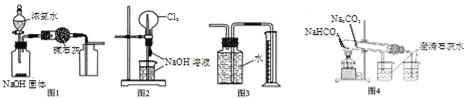题目内容
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素的负一价离子的最外层电子数与次外层的相同。F元素原子的价电子数比其余电子数少8。
(1)A、C、D的第一电离能由大到小的顺序为_____________(用元素符号表示),F在元素周期表中的位置__________。
(2)B、D形成的化合物中属于非极性分子的是_______(填化学式)。
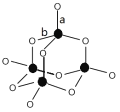
(3)B、C形成的某种化合物结构如图所示,该结构中C-B键的键长有两类,键长较短的键为_______________(填图中字母a或b),1mol该分子中含有的σ键数目为________。C、E形成某化合物,其分子中所有原子的最外层均为8电子稳定结构,该化合物的电子式为________。
(4)元素E的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(5)F可与CO形成羰基配合物F2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①F2(CO)8为_________晶体(填晶体类型)。
②F2(CO)8晶体中存在的作用力有_____________________。
【答案】 N>P>S 第四周期VIII族 SO3 a 16NA ![]() HClO4 正四面体型 分子 分子间作用力,共价键,配位键
HClO4 正四面体型 分子 分子间作用力,共价键,配位键
【解析】A元素原子核外有3个未成对电子,则电子排布式为1s22s22p3,即为N;B元素原子核外电子占有3个能级,其中最高能级上的电子数是其所在能层数的2倍,则电子排布式为1s22s22p4,即为O;D元素与B元素同族,则D为S;C元素与A元素同族,则C为P;E元素的负一价离子的最外层电子数与次外层的相同,E为Cl;F元素原子的价电子数是其余电子数的一半,以及原子序数最大,则F的电子排布式为1s22s22p63s23p63d74s2,则F为Co。
(1)同周期第一电离能从左向右增大,但IIA>IIIA、VA>VIA,同主族从上到下减小,因此三者的顺序是N>P>S;钴原子的核电荷数为27,电子排布式为1s22s22p63s23p63d74s2,在周期表中第四周期VIII族;正确答案:N>P>S ;第四周期VIII族。
(2)S和O形成化合物为SO2、SO3,SO2的孤电子对数为(6-2×2)/2=1,sp2杂化,属于V形,结构不对称,属于极性分子,SO3的孤电子对数为(6-3×2)/2=0,sp2杂化,平面三角形,结构对称,属于非极性分子;正确答案:SO3。
(3)P的最外层有5个电子,形成三个键达到饱和,b为形成的共价键,a为形成的配位键,因此较短的是a,两个成键原子间只能形成1个σ键,因此1mol 此物质含有σ键16NA;磷与氯形成三氯化磷,其分子中所有原子的最外层均为8电子稳定结构,电子式为![]() ;正确答案:a ;16NA ;
;正确答案:a ;16NA ; ![]() 。
。
(4)氯元素的含氧酸中,氯元素价态最高的含氧酸的酸性最强,化学式为HClO4;高氯酸根离子中中心原子氯原子:根据杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数可知,氯酸根离子中中心原子氯原子杂化轨道数=0+4=4,没有孤电子对,属于sp3杂化,为正四面体型;正确答案:HClO4 ;正四面体型。
(5)①根据题给信息可知,Co2(CO)8能溶于有机物,熔沸点较低,因此此配合物为分子晶体;正确答案:分子。
② Co2(CO)8属于分子晶体,存在的作用力有含有共价键、配位键、分子间作用力;正确答案:共价键、配位键、分子间作用力。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)基态磷原子核外有________种运动状态不同的电子。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如下所示,则其中“2”原子的结构示意图为________,“8”单质晶体的类型为________。


(3)氢化镁
储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为________,晶胞的体积为________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)Si、C和O的成键情况如下:
化学键 | C-O | C=O | Si-O | Si=O |
键能/(kJ·mol-1) | 360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:__________________________________________。