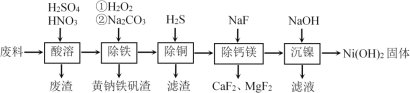
题目内容
【题目】氯酸钾在工业上具有广泛的应用,是焰火、照明弹等的主要成分。某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
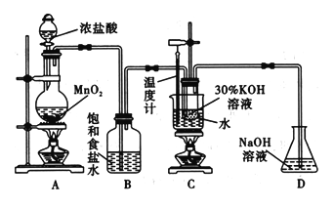
(1)写出装置A中发生反应的离子方程式:________________________________;写出装置C中发生反应的离子方程式:________________________________________。
(2)若无B装置,则装置C中氯酸钾的产率将________(填“提高” “降低”或“无影响”)。
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V3 =_______________。
②设计1号试管实验的作用是_________________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_____________________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为_________________________________。
【答案】MnO2+ 4H+ + 2Cl- ![]() Mn2++Cl2↑+2H2O 3Cl2 + 6OH- = 5Cl- + ClO3- + 3H2O 降低 1.0 6.0 硫酸浓度为0的空白对照实验 ClO3-+ 6I- + 6H+ = Cl- + 3I2 + 3H2O 2KClO3 + Na2SO3 + H2SO4=2ClO2 + K2SO4 + Na2SO4 + H2O
Mn2++Cl2↑+2H2O 3Cl2 + 6OH- = 5Cl- + ClO3- + 3H2O 降低 1.0 6.0 硫酸浓度为0的空白对照实验 ClO3-+ 6I- + 6H+ = Cl- + 3I2 + 3H2O 2KClO3 + Na2SO3 + H2SO4=2ClO2 + K2SO4 + Na2SO4 + H2O
【解析】
(1) 装置A制取氯气;装置C制备氯酸钾;
(2)生成的氯气中含有氯化氢,氯化氢能与氢氧化钾溶液反应,饱和食盐水除去氯化氢;
(3)①要研究硫酸浓度对反应产物的影响,需要保持其他条件相同,只改变硫酸的浓度;
②1号试管中没有加硫酸,实验的作用是硫酸浓度为0的空白对照实验;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,说明有碘产生;
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂C1O2,根据原子守恒和电子得失守恒可知还有硫酸钠、硫酸钾和水生成。
(1) 装置A制取氯气,其中发生反应的离子方程式:MnO2+ 4H+ + 2Cl- ![]() Mn2++Cl2↑+2H2O;装置C制备氯酸钾,其中发生反应的离子方程式为3Cl2+6OH-=ClO3-+3H2O+5Cl-;
Mn2++Cl2↑+2H2O;装置C制备氯酸钾,其中发生反应的离子方程式为3Cl2+6OH-=ClO3-+3H2O+5Cl-;
故答案为:MnO2+ 4H+ + 2Cl- ![]() Mn2++Cl2↑+2H2O;3Cl2+6OH-=ClO3-+3H2O+5Cl-;
Mn2++Cl2↑+2H2O;3Cl2+6OH-=ClO3-+3H2O+5Cl-;
(2)生成的氯气中含有氯化氢,氯化氢能与氢氧化钾溶液反应,饱和食盐水除去氯化氢,若无B装置,则装置C中氯酸钾的产率将降低。
故答案为:降低;
(3)①要研究硫酸浓度对反应产物的影响,需要保持其他条件相同,只改变硫酸的浓度,则V1=1.0、V2=6.0、V3=6.0。
故答案为:1.0;6.0;
②1号试管中没有加硫酸,实验的作用是硫酸浓度为0的空白对照实验。
故答案为:硫酸浓度为0的空白对照实验;
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,说明有碘产生;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6H++6I-=3I2+Cl-+3H2O。
故答案为:ClO3-+6H++6I-=3I2+Cl-+3H2O;
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂C1O2,根据原子守恒和电子得失守恒可知还有硫酸钠、硫酸钾和水生成,该反应的化学方程式为2KClO3+ Na2SO3+ H2SO4=2ClO2+ K2SO4+ Na2SO4+ H2O。
故答案为:2KClO3+ Na2SO3+ H2SO4=2ClO2+ K2SO4+ Na2SO4+ H2O。

 名校课堂系列答案
名校课堂系列答案【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
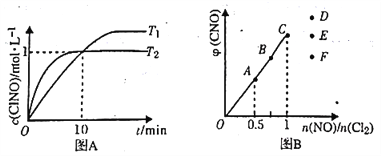
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。