题目内容
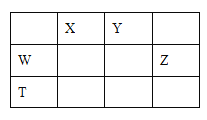
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素可以形成离子化合物
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
【答案】BD
【解析】
设W的最外层电子数为x,则X、Y、Z的最外层电子数分别为(x+1)、(x+2)、(x+3)。由题干信息:x+(x+1)+(x+2)+(x+3)=22,则x=4。由此可知:X为N元素、Y为氧元素、W为Si元素、Z为Cl元素、T为Ge元素。据此分析可得结论。
A.由于NH3分子、H2O分子之间可以形成氢键,故三种元素最低价氢化物沸点的大小顺序是HCl<NH3<H2O,故A说法错误;
B. N、O、H三种元素所形成的化合物NH4NO3含有离子键,故B说法正确;
C. SiCl4属于分子晶体,熔沸点较低,硬度较小,故C说法错误;
D. Ge元素位于金属和非金属的交界处,Ge元素的单质具有半导体的特性,Ge元素与Cl元素属于同主族元素,由其原子结构特点可知可以形成化合物GeCl4,故D说法正确;
答案选BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯酸钾在工业上具有广泛的应用,是焰火、照明弹等的主要成分。某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
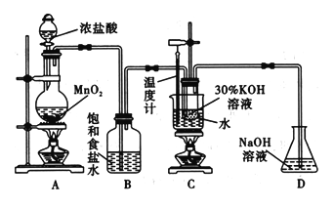
(1)写出装置A中发生反应的离子方程式:________________________________;写出装置C中发生反应的离子方程式:________________________________________。
(2)若无B装置,则装置C中氯酸钾的产率将________(填“提高” “降低”或“无影响”)。
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V3 =_______________。
②设计1号试管实验的作用是_________________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_____________________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为_________________________________。