题目内容
据下表信息,判断以下叙述正确的是( ) 部分短周期元素的原子半径及主要化合价
A.GOH溶液和M(OH)3可以相互反应
B.非金属性:T<Q
C.气态氢化物的稳定性:R>T
D.L2+与T2-核外电子数相等
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
A.GOH溶液和M(OH)3可以相互反应
B.非金属性:T<Q
C.气态氢化物的稳定性:R>T
D.L2+与T2-核外电子数相等
AD
试题分析:从表中来看G、L、M元素的的原子半径都比较大依次减小,且都为正价,所以是金属元素。而Q、T元素都有-2价,所以推测是第六主族元素,根据半径可得Q、T分别为元素S、O,由此可推R是N,G、L、M则分别为Na、Mg、Al。所以NaOH溶液和Al(OH)3可以相互反应,A正确;O的非金属性强于S元素,B错误;O的非金属性同样强于N元素,所以对应的氢化物稳定性也要强,C错误;Mg 在第三周期,O在第二周期,所以形成的离子Mg 2+与O2- 都具有相同的电子层结构,核外电子数相同,D正确;故选AD。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
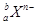 ,下列说法正确的是
,下列说法正确的是 g
g