题目内容
下列有关化学变化中的能量关系的说法中,错误的是( )
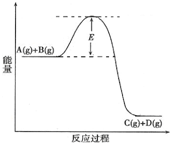
| A.任何一个化学变化的过程中都包含着能量的变化 |
| B.化学变化过程中能量变化的实质就是旧键断裂要吸收能量,新键生成会放出能量 |
| C.如果生成物的能量比反应物的能量高,则该反应为放热反应 |
| D.如不特别注明,化学反应的反应热就是就是该反应的焓变 |
A、化学变化的特征是:有新物质生成,伴随着能量变化,故A正确;
B、化学变化的实质反应物中旧键断裂和生成物中新键的形成,断键要吸收能量,成键要放出能量,故B正确;
C、如果反应物的能量大于生成物的能量,则该反应为放热反应,反之则为吸热反应,故C错误;
D、在恒压条件下的反应,反应的焓变等于反应的反应热,通常的反应都是在一个大气压条件下发生的,所以如不特别注明,化学反应的反应热就是就是该反应的焓变,故D正确;
故选C.
B、化学变化的实质反应物中旧键断裂和生成物中新键的形成,断键要吸收能量,成键要放出能量,故B正确;
C、如果反应物的能量大于生成物的能量,则该反应为放热反应,反之则为吸热反应,故C错误;
D、在恒压条件下的反应,反应的焓变等于反应的反应热,通常的反应都是在一个大气压条件下发生的,所以如不特别注明,化学反应的反应热就是就是该反应的焓变,故D正确;
故选C.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目

 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是  3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是 N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表: CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图: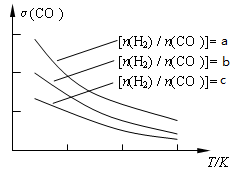
 Cl-
Cl-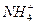 Cl-
Cl-
