题目内容
表中为一些短周期元素及相应氢化物沸点的数据:
| ||||||||||||||||||||||||||||||||||
A.Fe与浓硫酸、浓硝酸发生钝化现象,常温下可以铁制容器贮存运输浓硫酸、浓硝酸,故A正确;
B.工业生产硝酸的第一步是将氨气催化氧化生成NO,不是氨气在纯氧气中燃烧,故B错误;
C.工业生成硫酸用98.3%的浓硫酸吸收三氧化硫,工业生成硝酸用硝酸镁溶液吸收,故C错误;
D.浓硫酸具有强氧化性,可以氧化硫化氢,浓硫酸与氨气反应生成硫酸铵,浓硫酸具有吸水性,可以吸收水,故D正确;
故选AD.

(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
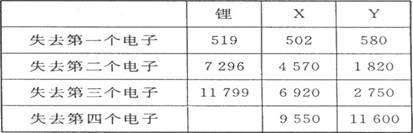
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5] |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成 的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
______________,其理由是 。
表中为一些短周期元素及相应氢化物沸点的数据:
元 素 性 质 | 元 素 编 号 | |||||
① | ② | ③ | ④ | ⑤ | ⑥ | |
氢化物的沸点(℃) | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
最 高 化 合 价 | +6 | +5 | +5 | +7 | ||
最 低 化 合 价 | -2 | -3 | -2 | -3 | -1 | -1 |
A、B、Y均为上表中的元素。X是一种历史悠久,应用广泛的金属元素。
① X与Y可形成化合物XY、XY2, 二者可用接触法制强酸甲;
② A与B可形成化合物AB、AB2,二者均可用于制备强酸乙。
请回答:
(1)元素 ③ 氢化物的分子式是 __________。
(2)下列有关强酸甲、乙说法正确的是 ________。
a. 二者的浓溶液在常温时均可用铁制或铝制的容器贮运
b. 二者的浓溶液在敞口容器中放置,质量都会变化
c. 工业生产强酸甲、乙时,都要用水吸收相应的氧化物
d. 二者的稀溶液均是强氧化剂
(3)工业生产强酸甲时可用浓氨水处理尾气,并获得某种铵盐。
化学方程式为__________________________________。
(4)写出工业生产强酸乙时获得AB的化学方程式: 。
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:
AB + AB2 + Na2CO3 = 2 ![]() + CO2
+ CO2
① 在方框内填某盐的化学式
② 每产生44.8 L(标准状况)CO2,被吸收尾气的质量是 ______g。
(6) 表中属于第三周期的元素是_______________(用表中元素编号填写)。
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
A.二者的浓溶液在常温时均可用X的单质制成容器储运
B.工业生产强酸乙的第一步是将②的氢化物在纯氧中燃烧氧化生成AB
C.工业生产强酸甲、乙时,都要用水吸收相应的氧化物
D.①②③的氢化物均能被强酸甲的浓溶液吸收