题目内容
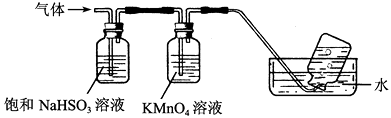
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).

注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
【答案】 Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O 浓H2SO4逐渐变稀,Zn与稀H2SO4反应可产生H2 检查装置的气密性 品红溶液 无水硫酸铜 防止空气中的水蒸气进入D中 C中黑色的固体变成红棕色,D中白色粉末变成蓝色.
ZnSO4+SO2↑+2H2O 浓H2SO4逐渐变稀,Zn与稀H2SO4反应可产生H2 检查装置的气密性 品红溶液 无水硫酸铜 防止空气中的水蒸气进入D中 C中黑色的固体变成红棕色,D中白色粉末变成蓝色.
【解析】(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O;(2)由于反应时浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;(3)装置是气体验证实验,所以在安装好装置后,必不可少的一步操作是先检查装置的气密性;(4)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,则D中试剂是无水硫酸铜;(5)为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,目的是防止空气中的水蒸气进入D中;(6)氢气具有还原性,能把氧化铜还原为铜,则证明气体X中含有氢气的实验现象是C中黑色的固体变成红棕色,D中白色粉末变成蓝色。
ZnSO4+SO2↑+2H2O;(2)由于反应时浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;(3)装置是气体验证实验,所以在安装好装置后,必不可少的一步操作是先检查装置的气密性;(4)分析装置图可知,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,则D中试剂是无水硫酸铜;(5)为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,目的是防止空气中的水蒸气进入D中;(6)氢气具有还原性,能把氧化铜还原为铜,则证明气体X中含有氢气的实验现象是C中黑色的固体变成红棕色,D中白色粉末变成蓝色。

 名校课堂系列答案
名校课堂系列答案