题目内容
【题目】短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,Y元素原子次外层电子数等于其最外层电子数的2倍。下列判断错误的是
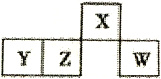
A. r(w)>r(z)>r(y)>r(x) B. 最简单气态氢化物的沸点:X>W
C. Y元素的最高价氧化物能与强碱反应 D. W的最髙价氧化物对应的水化物属于一元强酸
【答案】A
【解析】短周期Y元素原子次外层电子数等于其最外层电子数的2倍,则Y为Si元素,则X为氧元素、Z为磷元素、W为氯元素;A.同周期主族元素的原子半径随核电荷数增大而减小,故Si的原子半径大于磷、氯原子,氧原子核外少一个电子层,原子半径最小,故A错误;B.H2O的分子间存在氢键,水常温下为液态,而HCl常温下为气体,即H2O的沸点大于HCl,故B正确;C.SiO2是酸性氧化物,能与强碱溶液反应生成盐和水,故C正确;D.HClO4是最强酸且为一元酸,故D正确;答案为A。

【题目】用生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)按一定比例混合可制得一种腌制原料,某同学为了探究该原料成份做了以下实验:
该同学取一定量的样品溶于水,主要发生的化学方程式有:____________________________, _____________________________________。
(2)该同学认为(1)过滤后所得的滤液中肯定含有大量的NaOH、NaCl溶质,还可能含有Ca(OH)2或Na2CO3 ,为了探究所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
实验方案设计如下表所示:
实 验 步 骤 | 实 验 现 象 | 实 验 结 论 | 用离子方程式解释 |
①取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 | Ⅰ:________________ |
若无白色沉淀 | 滤液中无Ca(OH)2 |
| |
②取少量滤液,______________________________________________ | ⅰ:若出___________ | 滤液中含Na2CO3 | Ⅱ:_______________ |
ⅱ:若无___________ | 滤液中无Na2CO3 |
|
