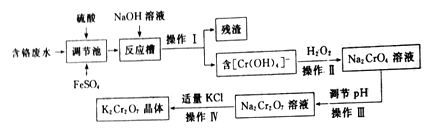
题目内容
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液制斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。

己知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升卨到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,
请写出发生堵塞时瓶b中的现象:①_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________________________________________;安全瓶b还可以起到的作用是③__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(6)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则 此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
【答案】 减少副产物乙醚生成 b中长直玻璃管内液柱上升 过度冷却,产品1,2-二溴乙烷在装罝d中凝固 防止倒吸 吸收乙烯气体中含有的CO2、SO2等酸性气体 浓硫酸将部分乙醇氧化 发生副反应生成乙醚;乙醇挥发;乙烯流速过快,未完全发生加成反应(写出两条即可) 乙醚 D 【答题空10】液封Br2 和1,2-二溴乙烷,防止它们挥发
【解析】(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,实验中应迅速将温度升高到170℃左右的原因是减少副产物乙醚生成;(2)根据大气压强原理,试管d发生堵塞时,b中压强的逐渐增大会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,故答案为:b中长直玻璃管内有一段液柱上升。1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却,就会在装置d中凝固造成堵塞。b装置导管短进长出,可以防止倒吸;(3)由于浓硫酸具有强氧化性,能够氧化碳,同时被还原成具有刺激性气味的二氧化硫气体,因此乙烯气体中混有CO2、SO2等酸性气体,所以c中NaOH溶液作用是吸收乙烯气体中含有的CO2、SO2等酸性气体;(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是发生副反应生成乙醚;乙醇挥发;乙烯流速过快,未完全发生加成反应等;(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故选D;(6)溴易挥发,在试管d中加入少量冰水可起到液封的作用,还可降低温度,减少挥发。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
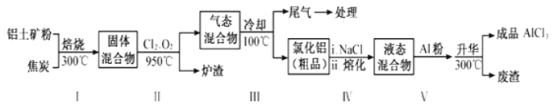
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。